Kimyasal Tepkimelerde Enerji Konu Anlatımı
Kimyasal tepkimeler gerçekleşirken ısı açığa çıkabilir veya ısı harcanabilir. Bu tepkimelerdeki ısı enerjisinin hesaplanması tepkime ile ilgili bilgi sahibi olmamız için gereklidir.
Tepkime Isısı (ΔH)
Bir tepkime oluşurken alınan veya verilen ısı enerjisine tepkime ısısı denir.
Alınan veya verilen ısı miktarı; bileşiğin elementlerinden oluşması sırasında ise oluşma ısısı, bir mol maddenin yanması sırasında ise molar yanma ısısı, asit ve baz tepkimelerinin nötrleşmesi sırasında ise molar nötrleşme ısısı diye adlandırılır.
Kimyasal tepkimeler oluşurken alınan veya verilen enerji ısı şeklinde olduğundan buna entalpi de denir. Isı kalorimetre ile ölçülür, birimi kaloridir. 1 kilokalori 1000 kaloriye karşılık gelir.
Kimyasal tepkimelerde açığa çıkan ısı tepkimeye giren maddeler ile oluşan ürünler arasındaki bağıl potansiyel enerji farkından meydana gelmektedir. Kimyasal tepkimeler oluşurken alınan veya verilen enerji miktarı çekirdek tepkimelerindeki enerjiden az, fiziksel olayların enerjisinden ise daha fazladır.
Tepkime denklemlerinde verilen ısılar o tepkimenin standart şartlardaki (basınç 1 atmosfer, sıcaklık 25 °C) değerleridir. Tepkime ısısı; tepkime sonunda oluşan ürünlerin toplam enerjilerinden, tepkimeye girenlerin toplam enerjilerinin çıkarılması ile bulunur. Serbest haldeki elementlerin oluşma ısıları sıfır kabul edilir.
Tepkime ısısı = Ürünlerin toplam enerjisi – Girenlerin toplam enerjisi
ΔH = ΔHürünler – ΔHgirenler
Tepkime ısısı hesaplanırken bileşiğin oluşma ısısı ile mol sayısı çarpılır. Çünkü tepkimede alınan veya verilen ısı miktarı madde miktarı ile doğru orantılıdır. Tepkime ısısı, tepkimeye giren ve çıkan maddelerin fiziksel hallerine bağımlı olduğundan tepkimeler yazılırken maddelerin fiziksel halleri katı (k), sıvı (s), gaz (g) şeklimde belirtilmelidir. Şimdi bir örnek verelim.
H2(g) + 1/2O2(g) → H2O(g) ΔH = -57,8 kk.
H2(g) + 1/2O2(g) → H2O(s) ΔH = -63,3 kk.
Suyun oluşumunda görüldüğü gibi oluşan maddelerin fiziksel hali değiştiğinde oluşma ısısı da değişmektedir.
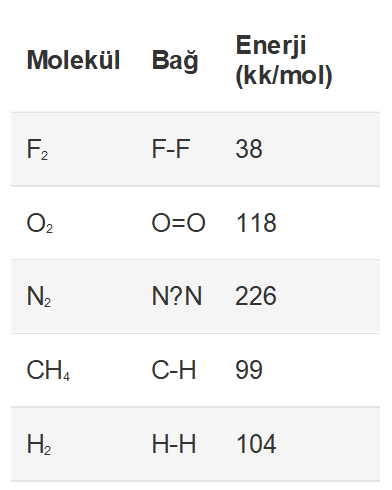
Moleküller arasındaki kimyasal bağları koparmak için gerekli olan enerjiye bağ enerjisi denir. Kimyasal bağlar oluşurken ısı açığa çıkar. Açığa çıkan ısı miktarı ne kadar büyük ise bağın kuvvetliliği de o ölçüde fazladır. Bazı moleküllerin ortalama bağ enerjileri aşağıdaki tabloda gösterilmiştir.
Tepkime Çeşitleri
Kimyasal tepkimelerde, tepkimeye giren ve çıkan maddelerin ısı kapsamları birbirinden farklı olduğundan bazı tepkimeler oluşurken dışarıya ısı verir, bazıları da dışarıdan ısı alır. Bundan dolayı ısı alış verişine göre tepkimeler ikiye ayrılır.
- Ekzotermik Tepkimeler
Bir kimyasal tepkimede, tepkimeye giren maddelerin toplam enerjileri oluşan ürünlerin toplam enerjilerinden fazla ise bu tür tepkimeler gerçekleşirken ortama ısı verirler. Böyle tepkimelere ekzotermik tepkimeler denir. Tepkime ısısının işareti negatiftir.
ΔHgirenler > ΔHürünler ΔH = (-)
- Endotermik Tepkimeler
Bir kimyasal tepkimede, tepkimeye girenlerin toplam enerjileri, oluşan ürünlerin toplam enerjilerinden daha az ise tepkime oluşurken dışarıdan ısı almıştır. Bu tarz tepkimelere endotermik tepkimeler denir.
ΔHgirenler < ΔHürünler ΔH = (+)
Tepkime Isısının Toplanabilirliği (Hess Yasası)
Bir kimyasal tepkime ters çevrildiğinde tepkime ısısı işaret değiştirir.
H2(g) + 1/2O2(g) → H2O(g) ΔH = -58 kk.
H2O(g) → H2(g) + 1/2O2(g) ΔH = 58 kk.
Tepkime ısısı, tepkimeye giren madde miktarı ile doğru orantılı olduğundan bir tepkime herhangi bir sayı ile çarpılır veya bölünürse tepkime ısısı da aynı sayı ile çarpılır veya bölünür.
C(k) + O2(g) → CO2(g) ΔH = -94 kk.
2C(k) + 2O2(g) → 2CO2(g) ΔH = -188 kk.
Bir tepkime iki veya daha fazla tepkimenin toplamından oluşuyorsa oluşan tepkimenin tepkime ısısı; oluştuğu tepkimelerin ısılarının toplamına eşittir.
Bileşiklerin oluşma ısıları veya tepkime ısıları kalorimetre kabındaki ısı değişiminden yararlanarak hesaplandığına göre; kalorimetre kabında genellikle;
Q = mk.Ck.Δt (k: kap) şeklindedir.