Çözeltiler Konu Anlatımı
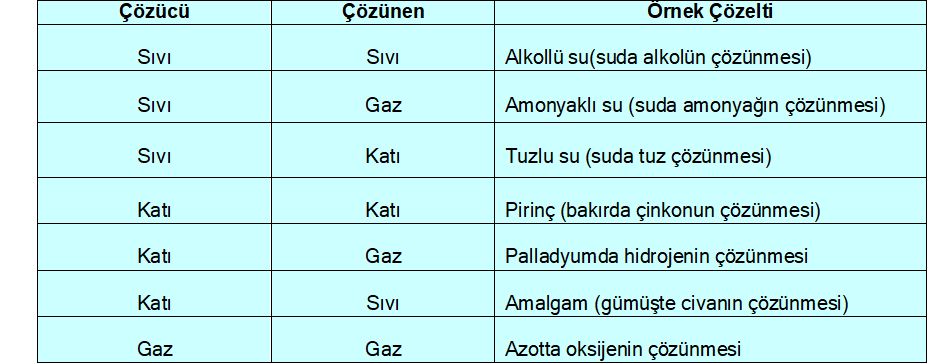
Çözeltiler, iki ya da daha fazla kimyasal maddenin herhangi bir oranda bir araya gelerek oluşturdukları özellikleri her yerinde aynı olan homojen karışımlardır. Bir çözeltide en az iki bileşen vardır. Çözelti içinde miktarı çok olan bileşene “çözücü”, miktarı az olan bileşene ise “çözünen” denir. Çözücü ve çözünen; katı, sıvı veya gaz olabilir. Buna göre çeşitli çözeltiler hazırlanabilir.
Çözücü sıvı ise, çözünenin sıvı, katı, gaz oluşuna göre 3 türlü; çözücü katı ise, çözünenin sıvı, katı, gaz oluşuna göre de 3 türlü çözelti hazırlamak mümkün olabilir. Çözücü gaz olduğunda ise, gazlar içinde sadece gazlar çözündüğünden tek tür çözelti hazırlanabilir. Katı ve sıvılarla gazlar homojen çözelti oluşturmazlar. Bütün bunlar arasında en sık kullanılan çözelti türleri sıvıda katı, sıvıda sıvı, sıvıda gaz çözeltilerdir.

Çözücü=Saf Su + Çözünen=NaCl = Çözelti=Tuzlu Su .
ÇÖZELTi ÇEŞiTLERi
Çözeltiler içerdikleri çözünen madde miktarına göre ikiye ayrılırlar.
a)Seyreltik Çözelti: Çözüneni az, çözücüsü çok olan çözeltidir.
b)Derişik Çözelti: Çözüneni çok, çözücüsü az olan çözeltidir.
Çözeltiler çözünenin çözünürlüğüne göre üçe ayrılırlar.
a) Doymuş Çözelti: Çözebileceği maksimum miktardaki maddeyi çözmüş olan çözeltilerdir
b) Doymamış Çözelti: Çözebileceği maksimum miktardan daha az çözünmüş madde içeren çözeltilerdir.
c) Aşırı Doymuş Çözelti: Çözebileceği maksimum miktardan daha fazla çözünmüş madde içeren çözeltilerdir.
Çözeltiler elektrik akımı iletkenliklerine göre ikiye ayrılırlar.
a) Elektrolit Çözeltiler: Sulu çözeltileri elektrik akımını iletiyorsa bu tip çözeltilere elektrolit çözeltiler denir.
b) Elektrolit Olmayan Çözeltiler: Sulu çözeltileri elektrik akımını iletmiyorsa bu tip çözeltilere elektrolit olmayan çözeltiler denir.
ÇÖZELTiLERiN ÖZELLiKLERi
Bir çözücüde, uçucu olmayan bir maddenin çözünmesi, onun buhar basıncını düşürür. Çünkü;
çözünen madde tanecikleri birim yüzeydeki çözücü taneciklerinin sayısını azaltır. Bu durum çözücünün zor buharlaşmasına neden olur. Buhar basıncının düşmesi de kaynama noktasının yükselmesine sebep olur. Yani çözelti saf çözücünün normal Saf su ve tuzlu suyun kaynama noktası farklıdır. kaynama noktasında kaynamaz. Şu halde uçucu olmayan maddelerin çözülmesiyle hazırlanan çözeltilerin kaynama noktaları saf çözücülerinkinden daha yüksektir. Örneğin tuzlu suyun donma noktası saf suyun donma noktasından büyüktür. %10’luk tuz çözeltisinin donma noktası -6 °C iken %20’lik tuz çözeltisinin donma noktası -16 °C’ ye düşer. Donma noktasında katı ve sıvının buhar basıncı eşittir. Sıvı çözücü ile katı çözücünün buhar basıncı eğrileri çözeltinin donma noktasında kesişir. Ancak bu sıcaklıkta çözeltinin buhar basıncı saf çözücünün denge buhar basıncından daha düşüktür. Çözeltinin buhar basıncı eğrisi, katı çözücünün buhar basıncı eğrisini daha düşük bir sıcaklıkta keser. Bu nedenle, çözeltinin donma noktası, saf çözücününkinden daha düşüktür.
Not: Otomobil radyatörlerinin suyuna etandiol (Glikol) C2H4(OH)2 suyun donma noktasını düşürür. Bu da kışın otomobil motorlarının içlerinde donan su ile çatlamasını önler böyle donma noktasını düşürerek donmayı geciktiren maddelere antifiriz denir
Kaynama noktasındaki yükselme ve donma noktası düşmesi çözeltideki çözünenin tanecik sayısı (derişimi) ile orantılıdır
ÇÖZELTiLERİN DERİŞİMLERİ
Belirli bir miktar çözelti veya çözücü içerisinde çözünen madde miktarına derişim denir. Derişimi düşük olan çözeltiler seyreltik çözelti, derişimi yüksek olan çözeltiler ise derişik çözelti olarak bilinir. Ancak bir çözeltide çözünen madde miktarının bilinmesi gerekir.
Bir çözeltide çözünen madde miktarını nasıl ifade ederiz?
Bir çözeltide çözünen madde miktarı, kütle, hacim, mol terimlerini içeren çeşitli derişim birimleri ile belirtilir. En çok kullanılan derişim birimleri, yüzde derişim, mol kesri, molarite, normalitedir.
Kütlece Yüzde Derişim
Çözeltinin 100 gramında çözünmüş olarak bulunan maddenin g cinsinden madde miktarına, kütlece yüzde derişim denir.
Çözünenin ağırlığı
Ağırlık yüzdesi = ――――――――――― x 100 şeklinde ifade edilebilir.
Çözelti kütlesi
Örneğin %20’lik NaCl çözeltisi demek 100 ağırlık birimi çözeltide (g, kg, mg, ton vb. olabilir) 20 ağırlık birimi NaCl var demektir. Böyle bir çözelti 20 g NaCl’in 80 g saf suda çözünmesiyle hazırlanabilir.
ÖRNEK: %20’lik 80 gram sekerli su çözeltisinde kaç gram seker, kaç gram su vardır?
ÇÖZÜM:
Y=20 mc=80 m=?
mc
Y = ——– x100den,
m
m
20 = —— x100 m= 16 g seker m=16 g şeker
80 80 – 16=64 g su vardır.
Molar Derisim (Molarite)
Bir litre (L) çözeltide çözünmüş halde bulunan maddenin mol sayısına molarite denir. Molarite, M sembolü ile gösterelir. Birimi mol / L’dir. Mol / L yerine “molar” ifadesi de kullanılabilir.
çözünenin mol sayısı
Molarite = ――――――――――
çözelti hacmi (L)
n
M= ――
V
ÖRNEK
12 gram NaOH ile 600 mL çözelti hazırlanıyor. Çözeltinin molar derişimi nedir? (NaOH:40)
ÇÖZÜM
m
n = ――
MA
12
n = —–=0,3 mol
40
600 mL= 0,6 L
0,3
M= ―― = 0,5 mol/L
0,6
- Çözeltiye çözücü eklenir veya buharlaştırılırsa, M1 . V1 = M2 . V2 bağıntısı kullanılır.
- Aynı tür çözeltiler karıştırılırsa, M1 . V1 + M2 . V2 + ….= Mson . Vtop bağıntısı kullanılabilir.
- Çözeltinin öz kütlesi, yüzdesi ve çözünenin mol ağırlığı biliniyorsa molar derişim,
10 d.%
M= ――――― bağıntısı kullanılabilir.
MA
NORMAL DERİSİM (NORMALİTE)
Çözeltinin bir litresinde çözünen maddenin es değer gram sayısına normalite denir.
çözünenin es değer gram sayısı
Normalite = —————————————————
çözelti hacmi
Normalite N, es değer kütle sayısı ε ve çözelti hacmi V ile gösterilirse;
ε
N= ––––– dir.
V
Bir maddenin mol kütlesinin tesir değerliğine (etki değerliği) bölümüne es değer gram denir.
Tesir değerliği (Etki değerliği):
Bilesikleri üc grupta toplayarak tesir değerliğini bulabiliriz.
1. Asitlerin tesir değerliği, asidin suya verebileceği H+ iyonu sayısıdır. HCl’in verebileceği H+ iyonu sayısı 1’dir. Tesir değerliği 1’dir.
H2SO4’in verebileceği H+ iyonu sayısı2’dir. Tesir değerliği 2’dir. H3PO4’in verebileceği H+ iyonu sayısı 3’tur. Tesir değerliği 3′ tur.
2. Bazlarda tesir değerliği, bazın suya verebileceği OH– iyonu sayısıdır.
KOH’in verebileceği OH– iyonu sayısı 1’dir. Tesir değerliği 1’dir.
Ca (OH)2’in verebileceği OH– iyonu sayısı 2’dir. Tesir değerliği 2’dir. Al(OH)3’in verebileceği OH– iyonu sayısı 3’tur. Tesir değerliği 3’tur.
3. Tuzlarda tesir değerliği, bir formül birimi içinde bulunan toplam (+) yük sayısına eşittir. KCl’de K, +1 yüklüdür. Tesir değerliği 1’dir.
CaCO3’te Ca, +2 yüklüdür. Tesir değerliği 2’dir.
Al2O3’te Al, +3 yüklüdür. Toplam yük +6 olacağından, tesir değerliği de 6’dır.
Kütle
Es değer gram sayısı (ε) = ————————
Es değer gram
• Normalite, molar derişim kullanılarak da bulunabilir. Molarite tesir değerliği ile çarpılırsa normaliteyi verir. Normalite = Molarite x Tesir değerliği
ÇÖZELTİLEREN BİLEŞENLERİNE AYRILMASI
Homojen karışımlar olan çözeltiler katı, sıvı veya gaz halinde olabilirler. Çözeltiler türlerine göre fiziksel yöntemlerle bileşenlerine ayrılabilirler.
Katı-katı çözeltiler (alaşımlar):
Ayırma işleminde alaşımı oluşturan metallerin erime noktası farkından yararlanılır. Erime noktası düşük olan katı sıvılaşınca başka bir kaba alınır. Böylelikle iki katıdan oluşan bir alaşım bileşenlerine ayrılmış olur.
→bronz sikke (bakır –kalay alaşımı)
Sıvı-sıvı çözeltiler:
Ayırma işleminde kaynama noktaları farkından yararlanarak ayırma işlemi yapılır (ayrımsal damıtma). İki veya daha çok sıvıdan oluşan bir homojen karışımda sıvı bileşenleri, kaynama noktaları farkına göre ayırıp, her birini ayrı ayrı elde etme işlemine ayrımsal damıtma denir. Alkol-su karışımı bu yolla ayrılır. Alkolün kaynama noktası, sudan daha düşük olduğundan toplama kabında alkol toplanır. Ayrımsal damıtmada, bileşenlerin kaynama noktaları arasındaki fark ne kadar büyük ise ayırma o kadar kolay olur. Ham petrolün damıtılması sonucu fuel-oil, benzin, motorin vs. gibi ürünlerin elde edilmesi buna örnektir.
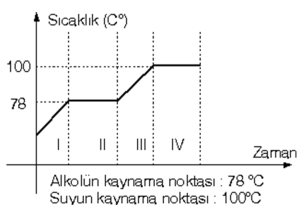
ÖRNEK: Alkol-su karışımının ısıtılması sırasında zamana bağlı sıcaklık değişim grafiği çizilseydi aşağıdaki gibi olurdu.
Grafige göre;
1. bölgesinde alkol – su karışımı vardır. Zamanla karışımın sıcaklığı artmaktadır.
2.bölgesinde 78 °C’de alkol kaynamaktadır. Verilen ısı alkolün buharlaşması için kullanılır.Sıcaklık alkolün tamamı tükeninceye kadar sabit kalır.
3. bölgesinde yalnız su vardır. Suyun sıcaklığı zamanla artar.
4. bölgesinde su 100 °C’de buharlaşmaktadır. Su tükeninceye kadar sıcaklık sabit kalır.
Sıvı-katı çözeltiler:
Çözelti ısıtılarak çözücü buharlaştırılır, çözünen katı kabın tabanında kalır. Bir katı-sıvı homojen karışımının ısıtılarak buharlaştırılması ve oluşan buharın soğutularak yoğunlaştırılmasına damıtma denir. Burada ayırma, sıvının kaynama noktasının, katının kaynama noktasından çok daha düşük olması esasına dayanmaktadır. Deniz suyundan içme suyu elde edilmesi damıtma yöntemiyle gerçekleştirilmektedir.
Gaz – gaz çözeltiler:
Gaz karışımı önce sıvılaştırılır. Sonra ayrımsal damıtma ile bileşenlerine ayrılır.
Kaynama noktaları farkına göre ayırma, gaz karışımlarını da bileşenlerine ayırmak için kullanılabilir. Bir gazın sıvı hale geçtiği sıcaklığa yoğunlaşma noktası denir. Bu sıcaklık, aynı maddenin kaynama noktasına eşittir. Bir gaz karışımı soğutulursa, önce kaynama noktası en yüksek olan gaz yoğunlaşmaya başlar ve yoğunlaşma sırasında sıcaklık sabit kalır. Bu gaz, karışımdan ayrıldıktan sonra sıcaklık tekrar düşer. Başka bir gaz bileşeninin kaynama noktasına gelindiğinde de bu bileşen yoğunlaşır. İşlem bu şekilde sürer.