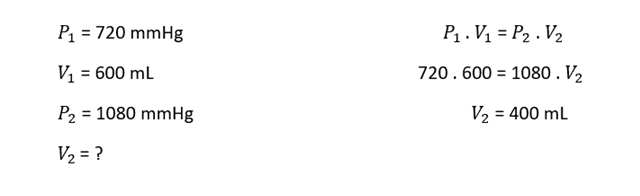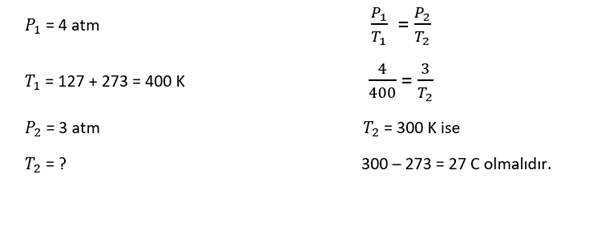Gazlar Konu Anlatımı
Gazların Genel Özellikleri – Gazlar Konu Anlatımı
• Taneciklerin serbest hareketi
o Tanecikli yapı katı, sıvı ve gazlar için ortak özelliklerdir. Fakat gazlarda tanecikler birbirinden bağımsız, gelişi güzel öteleme hareketi yapar. Örneğin bir odada sıkılan bir parfüm odanın her yerine yayılır.
• Belli bir hacimleri yoktur
o Gaz tanecikleri arasında sıvılardaki gibi kohezyon etkisi yoktur. Bu nedenle gazlar bulundukları kabın hacmini alarak kabın içine homojen şekilde dağılır. Bir miktar gaz, 5 litrelik kabı da 10 litrelik kabı da doldurur.
• Sıkıştırılabilir
o Katı ve sıvıların tanecikleri arasında çok az boşluk vardır ve bu yüzden sıkıştırılamaz. Fakat gazlar, balonda olduğu gibi, kolaylıkla sıkıştırılabilir. Dalgıç tüplerinin hacimlerinde yaklaşık 600 litrelik hacim kaplayan hava, yüksek basınç altında üç litrelik dalgıç tüpüne sıkıştırılabilir.
• Yoğunlukları katı ve sıvılara göre daha düşüktür.
• Gaz molekülleri öteleme, dönme ve titreşim hareketlerini yapabilir.
• Maddenin en düzensiz hâlidir.
Gaz basıncı için kullanılan birimler nelerdir?
Gaz molekülleri, bulundukları kabın içinde homojen olarak dağılır ve sürekli hareket hâlindedir. Bu hareketler sırasında hem birbirlerine hem de bulundukları kabın yüzeyine çarparak bir kuvvet uygularlar. Bu kuvvete gaz basıncı denir ve P ile gösterilir.
• Gaz basıncı birim hacimdeki taneciğin sayısı, hızı ve taneciklerin çarpışma sayısıyla orantılı olarak değişir.
• Kapalı kaplardaki gaz basıncı manometrelerle ölçülür.
• Atmosferde bulunan gazların uyguladığı basınca atmosfer basıncı (atm) denir.
• Atmosfer basıncını ölçmek için barometre kullanılır.
• Deniz seviyesinde 0 C sıcaklıktaki atmosfer basıncı 1 atmosferdir ve Po ile gösterilir.
• 1 atm = 76 cmHg = 760 mmHg = 760 Torr
• 1 mmHg = 1 Torr
Gaz Yasaları
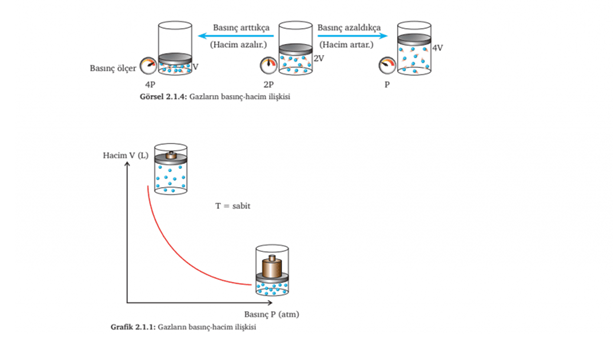
BOYLE YASASI (Basınç-Hacim İlişkisi):
Sabit sıcaklıkta belirli miktardaki gaza;
• Yüksek basınç uygulandığında hacminin küçüldüğünü,
• Basınç azaltıldığında ise hacminin arttığını ispatlamışlar.
Yani kısaca sabit sıcaklıkta belirli bir miktar gazın basıncı ile hacmi ters orantılıdır diyebiliriz.
• P1.V1 = P2.V2
o n: sabit
o T: sabit
o P = Basınç
o V = Hacim
o n = mol miktarı
o T = sıcaklık
Gazlar Soru Çözümü
SORU: Belirli sıcaklıkta bir miktar gaz 720 mmHg basınçta 600 mL hacim kaplamaktadır. Aynı sıcaklıkta bu gazın basıncı 1080 mmHg ye çıkarılıyor. Buna göre, bu gazın hacmi kaç mL olur?
Birbirleriyle tepkime vermeyen farklı kaplardaki gazlar karıştırıldığında basınç-hacim bağıntısı:
P1.V1 + P2.V2 + P3V3 + … = Pson.Vson ile bulunur.
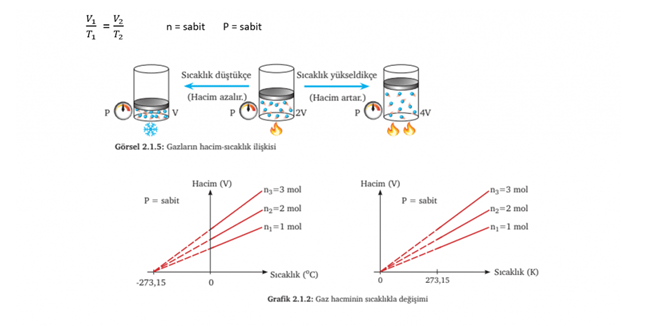
CHARLES YASASI (Hacim-Sıcaklık İlişkisi)
Sabit basınçta belirli miktar gazın;
• Sıcaklığı arttıkça hacmi artar
• Sıcaklık azalırsa hacmi de azalır.
Yani kısaca sabit sıcaklıkta belirli bir miktar gazın sıcaklığı ile hacmi doğru orantılıdır.
NOT : -273,15 C sıcaklığına mutlak sıfır noktası adı verilir. Mutlak sıfır noktasını başlangıç noktası olarak kabul eden sıcaklık ölçeğine Kelvin (mutlak) sıcaklık ölçeği denir. Günlük hayatta sıcaklıklar Celcius ölçeğine göre ölçülür.
Fakat gazlarla ilgili hesaplamalarda sıcaklık birimi Celcius, Kelvin’e dönüştürülerek kullanılır.
T (K) = t (C) + 273
Soru
Hareketli pistonlu bir kapta 327 C de 12 litre hacim kaplayan gaz bulunmaktadır. Bu gazın sıcaklığı 127 C ye düşürülürse hacmi kaç litre olur?
Çözüm
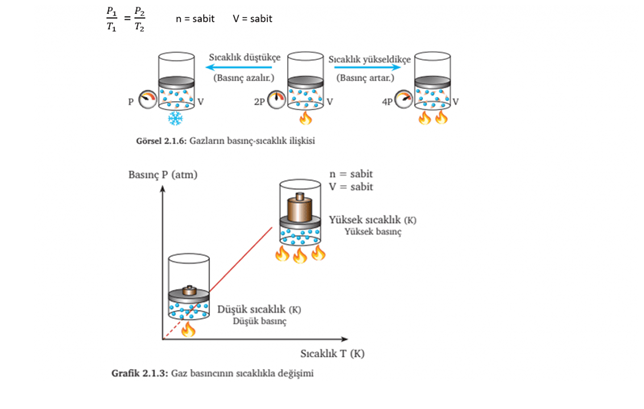
GAY-LUSSAC YASASI (Basınç-Sıcaklık İlişkisi)
Sabit hacimde belirli miktar gazın;
• Sıcaklık arttıkça basınç artar
• Sıcaklık azalırsa basınç da azalır
Yani kısaca sabit hacimde belirli miktar gazın sıcaklığı ile basıncı doğru orantılıdır.
NOT: Sıcaklık artışı sonucunda taneciklerin ortalama kinetik enerjileri de artar.
Soru
Sabit hacimli bir kapta 127 C de 4 atm basınç yapan He(g) vardır. Bu gazın basıncının 3 atm olması için sıcaklığı kaç C olmalıdır?
Çözüm
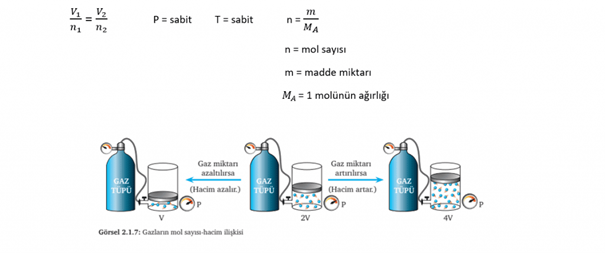
AVOGADRO YASASI (Mol Sayısı-Hacim İlişkisi)
Sabit sıcaklık ve basınçta gazın;
• Mol sayısı arttıkça hacim artar
• Mol sayısı azalırsa hacim de azalır
Yani kısaca sabit basınç ve sıcaklıktaki (aynı koşullardaki) bir gazın miktarı ile hacmi doğru orantılı olarak değişir.
Önemli NOT:
• Sıcaklığın 0 C (273 K), basıncın 1 atm olduğu koşullara normal şartlar (NŞ),
• Sıcaklığın 25 C (298 K), basıncın 1 atm olduğu koşullara da standart koşullar (oda koşulları) (SK) denir.
• 1 mol gazın hacmi normal şartlarda (NŞ) 22,4 L
• 1 mol gazın haci standart koşullarda (oda koşullarında) 24,5 L olarak ölçülmüştür.
Soru
Sabit sıcaklıkta serbest sürtünmesiz pistonlu bir kaba bir kaptaki gazın mol sayısı iki katına çıkarıldığında hangi olaylar meydana gelir?
Çözüm
– Hacmi iki katına çıkar
– Birim hacimdeki molekül sayısı değişmez.
– Taneciklerin ortalama kinetik enerjileri değişmez. (Sıcaklığa bağla)
– Taneciklerin ortalama hızı değişmez
– Gaz yoğunluğu değişmez.
İDEAL GAZ YASASI
Gaz yasalarına uyan, molekülleri birbirinin davranışından etkilenmeyen ve molekülleri arasında çekim kuvveti olmayan varsayımsal gazlara ideal gazlar denir.
• Tüm gazlar yüksek sıcaklık ve düşük basınçta ideale yaklaşırlar.
• Basınç arttıkça ve sıcaklık azaldıkça gazlar ideal durumdan uzaklaşırlar.
• Küçük mol kütleli ve polarlığı düşük olan gazlar ideale daha yakındır.
İdeal gaz denklemi:
Boyle, Charles ve Avogadro yasalarında ifade edilen denklemlerden yararlanılarak elde edilmiştir.
P.V = n.R.T (Denklemi aklında tutmak için “paran varsa ne rahat” şeklinde kodlayabilirsin ? ) bu denkleme ideal gaz denklemi denir ve orantı sabiti ve gaz sabiti = R olarak adlandırılır
• P = Basınç birimi atm
• V = Hacim birimi litre (L)
• N = mol sayısı
• R = 22.4/273 veya 0,082 değerlerini alır. Sorularda hangisi işlemlerimizi yapmamızda kolaylık sağlarsa o değeri alırız. Birimi L.atm/mol.K ‘dir.
• T = Sıcaklık Birimi Kelvin (K)
Gaz hâldeki bir maddenin mol kütlesi ve yoğunluğu da ideal gaz denkleminden yararlanılarak hesaplanabilir. İdeal gaz denkleminde mol sayısı yerine:
Soru
Kapalı bir kapta bulunan NO gazının basıncı 1,64 atm, sıcaklığı 127 oC olduğuna göre kaptaki gazın özkütlesini hesaplayınız. (N:14 g/mol, O:16 g/mol)
Çözüm
Gazlarda Kinetik Teori
Bilim insanları 19. yüzyılda yaptıkları çalışmalarla gazların davranışını açıklamışlardır. Gazların davranışını açıklayan teoriye kinetik teori denir. Kinetik teoriye göre
• Gaz molekülleri gelişigüzel ve sürekli hareket eder, birbirleriyle ve kap yüzeyiyle çarpışır. Bu çarpışmalar hızlı ve esnektir (Brown hareketi).
• Gaz molekülleri arasındaki uzaklık gazın öz hacmine göre çok büyük olduğu için gazların öz hacmi ihmal edilir.
• Gaz molekülleri arasındaki uzaklık oldukça fazladır. Bu nedenle gaz moleküllerinin birbirleriyle çarpışma anı dışında aralarında hiçbir zayıf etkileşim olmadığı varsayılır.
• Gaz moleküllerinin kinetik enerjileri mutlak sıcaklıkla doğru orantılıdır. Bu nedenle aynı sıcaklıktaki gaz moleküllerinin ortalama kinetik enerjileri birbirine eşittir.
• Kinetik enerjileri eşit olan gaz moleküllerinden molekül kütlesi küçük olanın hızı daha fazladır.
• Bir gaz, kinetik teori varsayımlarına ne kadar yakın davranıyorsa ideal gaz olmaya da o kadar yakındır.
Gazlarda Difüzyon Yasası
Gaz moleküllerinin aynı ya da farklı gaz molekülleri arasında yayılmasına difüzyon denir.
Kapalı bir kapta bulunan gaz moleküllerinin küçük bir delikten boşluğa yayılmasına da efüzyon denir
Gaz taneciklerinin hızı ile molekül kütleleri arasındaki bağıntıya Graham Difüzyon Yasası denir. Graham Difüzyon Yasasıʼna göre bir gaz molekülünün difüzyon veya efüzyon hızı taneciklerin mol kütlelerinin kareköküyle ters orantılıdır.
Gaz Karışımları
Kısmi Basınç Ve Mol Kesri
• Gaz karışımlarının bulunduğu ortama yaptığı basınç, karışımı oluşturan gazların basınçlarının toplamına eşittir
• Karışımdaki bir gazın tek başına uyguladığı basınca kısmi basınç denir
• Daltonʼun Kısmi Basınçlar Yasasıʼna göre bir gaz karışımındaki toplam basınç, karışımdaki her bir gazın kısmi basınçlarının toplamına eşittir.
• Bir gaz karışımındaki toplam basınç (PT), gaz moleküllerinin yapısına değil, karışımdaki gazların toplam mol sayısına bağlıdır.
• Herhangi bir X gazının kısmi basınç formülü, gazın toplam basınç formülüne oranlandığında aşağıdaki bağıntı elde edilir.
Gerçek Gazlar
• Tanecikleri birbirinden etkilenir.
• Tanecikleri arasında itme – çekme kuvvetleri vardır.
• Basınçla sıvılaşabilir.