Karbon Kimyasına Giriş Konu Anlatımı
- Anorganik ve Organik Bileşikler
- Basit Formül ve Molekül Formülü
- Doğada Karbon
- Lewis Formülleri
- Hibritleşme-Molekül Geometrileri
Anorganik ve Organik Bileşikler
Organik bileşikler, canlı organizmaları oluşturan maddelerdir. Mesela; biyoloji dersinde sıkça duyduğumuz karbonhidratlar, proteinler, yağlar birer organik bileşiktir. Organik olmayan bileşiklere de “anorganik bileşikler” veya “inorganik bileşikler” denir.
- “Karbon Kimyası” ve “Organik Kimya” aynı anlama gelen kavramlardır.
- Karbon Kimyası; organik bileşiklerin yapısını, özelliklerini ve üretim yollarını inceleyen kimya disiplinidir.
- Karbon (C) temelli yani C elementinin oluşturduğu bileşiklere “organik bileşikler” denir.
- Organik olmayan bileşiklere “anorganik bileşikler” veya “inorganik bileşikler” denir.
- Organik olmayan bileşikleri inceleyen kimya disiplinine “anorganik kimya” veya “inorganik kimya” denir.
Vitalizm İnancı
- 19. yüzyıla kadar, organik bileşiklerin sadece canlı organizmalar tarafından sentezlenebildiğini ileri süren ve “vitalizm (yaşam gücü)” olarak bilinen bir inanış hâkimdir.
- Bu görüş, organik bileşiklerin kimya laboratuvarında sentezlenemeyeceğini ileri sürmüştür.
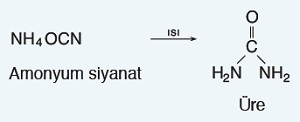
- Friedrich Wöhler (Firedrik Völer) 1828 yılında anorganik bileşiklerden yola çıkarak laboratuvar koşullarında ilk organik bileşiği sentezlemeyi başarmıştır.
- Wöhler, bir organik bileşik olan üreyi, tesadüfen de olsa; anorganik bir bileşik olan amonyum siyanatın sulu çözeltisini ısıtarak elde etmiştir.
Amonyum Siyanattan Üre Sentezi
- Wöhler’in bu sentezinden sonra; bilim dünyası, organik bileşiklerin de laboratuvarlarda sentezlenebileceğini anlamıştır ve “vitalizm” yavaş yavaş yerini organik kimya bilimine bırakmaya başlamıştır.
- 1850’li yıllardan itibaren “vitalizm” tamamen yok olmuştur.
Organik ve Anorganik Bileşiklerin Özellikleri
- Organik ve anorganik benzerlik ve farklılıklar şunlardır:
Organik Bileşikler
- Bütün organik bileşiklerde C elementi mutlaka vardır.
- Aşağıdaki bileşikler, bu durumun istisnasıdır ve anorganik bileşiklerdir:
CO2, CO, CaC2, KCN, Na2CO3, H2CO3, CaCO3
- Aşağıdaki bileşikler, bu durumun istisnasıdır ve anorganik bileşiklerdir:
- Organik bileşik sınıflarından bazıları şunlardır:
- Hidrokarbonlar
- Alkoller
- Eterler
- Aldehitler
- Ketonlar
- Karboksilli asitler
- Esterler
- Korbonhidratlar
- Aminler
- Amidler
- Doğadaki bileşiklerin yaklaşık %98’i organik bileşiktir.
- Organik bileşiklerin hemen hemen tamamında, C ile birlikte H elementi de vardır.
- Bir çok organik bileşikte, C ve H elementlerinin yanı sıra; O, S, N, P, F, Cl, Br gibi ametaller de bulunur.
- Organik bileşikler kovalent yapılıdır.
- Organik bileşiklerin tepkimeleri genellikle yavaştır ve çoğunlukla katalizör gerektirir.
- Bu nedenle mekanizmalar üzerinden yürür.
- Organik bileşikler genellikle suda çözünmez, organik çözücülerde çözünür.
- Organik bileşiklerin erime ve kaynama noktaları genellikle düşüktür ve çoğu kolaylıkla yanar.
Anorganik Bileşikler
- Anorganik bileşikler genellikle şunlardır:
- Asitler
- Bazlar
- Tuzlar
- Oksitler
- Anorganik bileşiklerin, organik bileşiklere göre sayıları daha azdır.
- Anorganik bileşiklerde, bütün elementler bulunabilir.
- Anorganik bileşikler kovalent ya da iyonik yapılı olabilmektedir.
- Anorganik bileşiklerin tepkimeleri ise; genellikle daha hızlıdır.
- Anorganik bileşiklerin çoğu suda çözünür.
- Anorganik bileşiklerin erime ve kaynama noktaları genellikle daha yüksektir ve çoğu yanmaz.
Organik Bileşik Örnekleri
- Organik bileşiklerin formüllerine baktığımızda C ve H elementi görürüz.
- Yani; bir bileşiğin formülünde hem C hem de H elementi varsa o bileşik için organik bileşiktir diyebiliriz.
Aşağıda, bazı organik bileşikler verilmiştir:
- CH4
- C2H6
- C2H5OH
- C2H4
- CH3OCH3
- CH2O
- C6H12O6
- C2H5COOH
- HCOOH
- CH3COOH
- CH3SH
- CHCl2F
İSTİSNA:
Şu bileşikler, C elementi içerdikleri halde organik bileşik değillerdir:
- CO32-(Karbonat kök iyonu) içerene bileşikler:
- Na2CO3
- H2CO3
- CaCO3
- …
- CN–(Siyanür kök iyonu) içeren bileşikler:
- KCN
- NaCN
- Ca(CN)2
- …
- Karbon elementinin oksitleri:
- CO2
- CO
- C4-(Karbür) bileşikleri:
- CaC2
Anorganik Bileşik Örnekleri
- Bugüne kadar öğrendiğimiz bileşiklerin hemen hemen hepsi anorganik (inorganik) bileşiklerdi.
- Organik bileşikler, C elementinin bileşikleridir fakat; anorganik bileşiklerde böyle bir sınırlama yoktur. Bütün elementler, anorganik bir bileşik yapabilir.
- Anorganik bileşikler; asitler, bazlar, tuzlar ve oksitler olarak sınıflandırılır. Aşağıda bu bileşiklere örnekler verilmiştir:
- Baz: NaOH (Sodyum hidroksit)
- Asit: H2SO4 (Sülfürik asit veya zaç yağı veya akü asidi)
- Tuz: NaCl (Sodyum klorür veya yemek tuzu)
- Oksit: Al2O3 (Alüminyum oksit)
- Oksit: FeO (Demir (II) oksit)
- Oksit: SO2 (Kükürt dioksit)
Basit Formül ve Molekül Formülü
- Basit Formül ve Molekül Formülü, aynı bileşiğin iki farklı formülüdür. Çünkü; molekül formüllerini göstermek için geliştirilmiş farklı modeller vardır.
Organik Bileşiklerin Formülleri
- Bileşiklerin formüllerini yazmanın sadece bir tane yolu yoktur.
- Aynı bileşiğin formülünü, farklı şekillerde göstermek mümkündür.
- Özellikle organik bileşiklerde, molekülleri daha detaylı olarak görmek isteriz. Bunun için de farklı formüllerden yararlanırız.
- Molekül formüllerini göstermek için kullanılan başlıca formül türleri şunlardır:
- Molekül Formülü
- Basit Formül ( Kaba veya Ampirik formül de denir.)
- Açık Formül
- Yarı Açık Formül
- Çizgi-Bağ (İskelet) Formülü
Gelin bu formülleri, daha yakından tanıyalım.
- Molekül Formülü
- Molekül formülü; kovalent bağlı bileşikler için, bu güne kadar kullandığımız formüllerdir.
- Kovalent bağlar ile birbirine bağlanmış atomlara molekül diyoruz. Kovalent bağlı bileşikler, moleküllerden oluşan bileşiklerdir, yani; moleküler bileşiklerdir.
- Bir bileşiğin molekülünün formülü aynı zamanda o bileşiğin de formülüdür.
- Molekül formüllerinde, şunlar vardır:
- Bir tane molekülde bulunan atomların sembolleri yer alır.
- Moleküldeki her bir atomun sayısı, sembolünün sağ-alt köşesine yazılır.
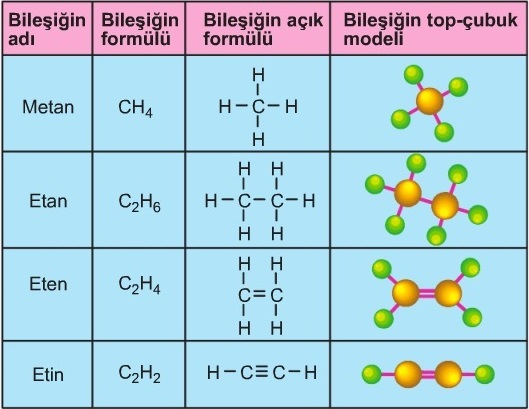
- Aşağıda bazı bileşiklerin molekül formülleri verilmiştir:
- H2O (Su)
- CH4 (Metan)
- C2H2 (Asetilen)
- C2H6 (Etan)
- C4H10 (Bütan)
- C2H5OH (Etil alkol)
- Basit Formül
- Basit formüle; “Ampirik formül” veya “Kaba formül” de denir.
- Basit formül; kovalent bağlı bileşiklerin molekül formüllerinin sadeleştirilmesi ile elde edilir.
- Bileşiklerin basit formüllerinin özellikleri şunlardır:
- Moleküldeki atomların sembollerinden oluşur.
- Moleküldeki atomların sayıları sadeleştirilmiş olarak yer alır.
- Molekül formülünün kaç ile sadeleştiği bilinmiyorsa, basit formülden, molekül formülüne ulaşılamaz.
- Basit formüldeki bütün oranlar, molekül formülündeki oranlar ile aynıdır. (Sadeleşen sayıların oranı değişmez.)
- Farklı bileşiklerin basit formülleri aynı da olabilir.
- Bir bileşiğin; molekül formülü ile basit formülü aynı olabilir.
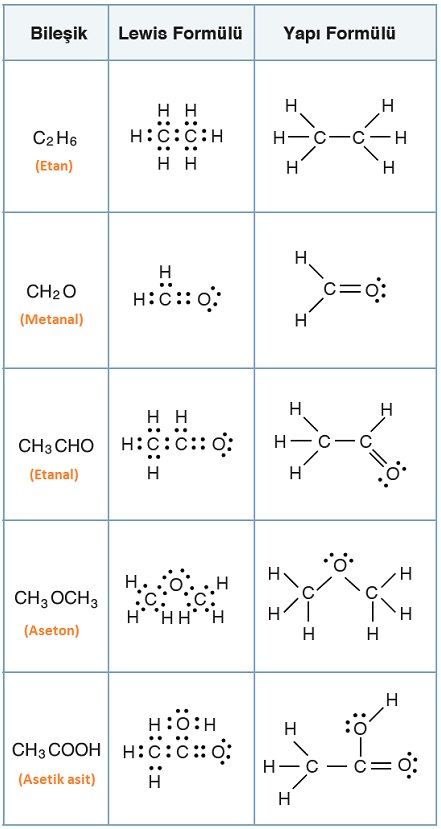
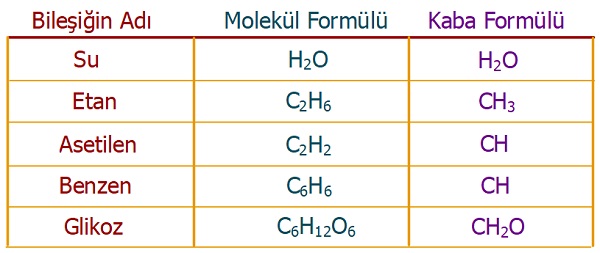
Aşağıda, bazı bileşiklerin molekül formülleri ve basit formülleri verilmiştir:
Bazı bileşiklerin basit ve molekül formülleri
- Açık Formül (Yapı Formülü)
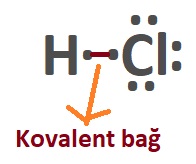
- Açık formülde, moleküldeki atomların yaptıkları kovalent bağlar da gösterilir.
- Kovalent bağ; atomların arasına çizilen kısa bir çizgi ile (“―“) gösterilir.
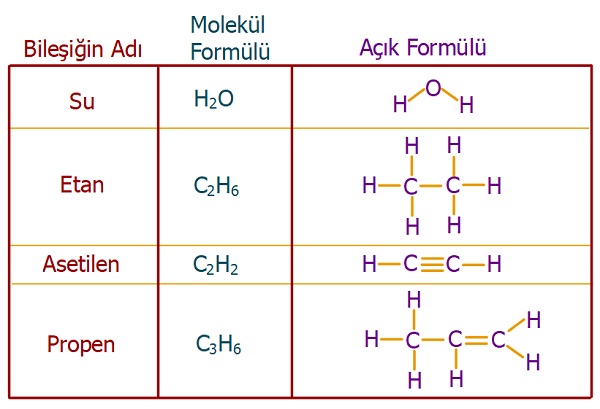
- Aşağıda, bazı bileşikler ve açık formülleri verilmiştir.
Bazı bileşiklerin açık (yapı) formülleri
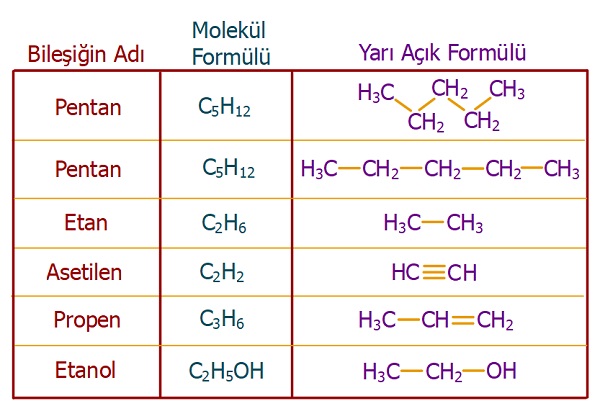
- Yarı Açık Formül
- Organik bileşiklerde bol bol karbon ve hidrojen atomu vardır.
- Hidrojenler, bütün organik bileşiklerde, karbon atomu ile tek bir kovalent bağ yapar:
C―H - Bu yüzden, organik bileşiklerin açık formüllerinde, C―H bağını göstermek biraz vakit ve yer kaybı gibi olur.
- Bu yüzden, yarı açık formüller geliştirilmiştir.
- Yarı açık formüllerde, C―H bağı veya O―H bağı, gibi H atomunun bağları açık olarak gösterilmez, buna gerek duyulmaz.
Aşağıda, bazı bileşikler ve yarı açık formülleri verilmiştir:
Bazı bileşiklerin yarı açık formülleri
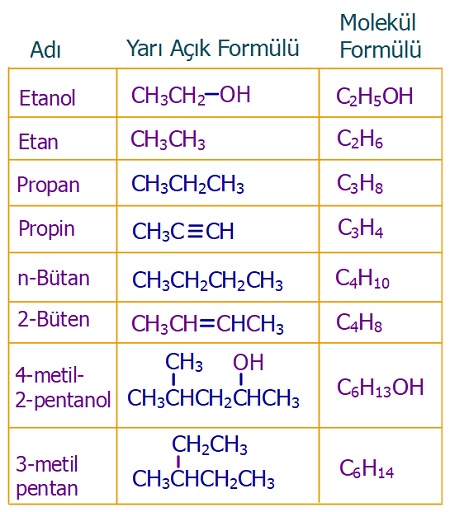
- Yarı açık formül, bazen molekül formülü ile birleştirilir ve tekli bağ yapmış ve ardışık C atomları arasındaki bağlar gösterilmez.
- Aşağıda bu durumun örnekleri verilmiştir.
Yarı Açık Formül
- Çizgi-Bağ (İskelet) Formülü
- Çizgi-bağ formülleri, organik moleküllerdeki atomların bağ yapısını basit bir şekilde gösteren formüllerdir.
- Bir nevi, organik moleküllerin röntgeninin çekilmiş ve iskeletinin göründüğü haldir.
- Çizgi-bağ formüllerinde, organik moleküllerin genel kısımları gösterilmez.
- Organik moleküllerin çizgi-bağ formüllerinde aşağıdaki parçalar görünmez:
- C atomları
- C atomlarına bağlı H atomları
- C ile H arasındaki bağlar
- Diğer ametaller ile H arasındaki bağlar
- Çizgi-bağ formüllerinde sadece aşağıdaki unsurlar görünür:
- C atomları arasındaki bağlar
- C ile H dışındaki ametaller arasındaki bağlar.
- C dışındaki ametallere bağlı olan H atomları
- Çizgi-bağ formüllerinde, peş peşe gelen bağlar birer çizgi ile ve zikzaklı çizilir.
- Zikzaktaki her bir düz çizgi bir kovalent bağdır ve bu çizgilerin başında ve sonunda görünmeyen birer C atomu vardır.
Öğretici Örnek:
- Örnek olarak C3H8bileşiği üzerinden çizgi-bağ formülünü anlamaya çalışalım.
- C3H8bileşiğinin yapı formülü şöyledir:
- Bu bileşiğin çizgi-bağ formülünü yazmak için, yapı formülünden silmemiz gereken kısımları kırmızı renk ile gösterelim:
- Yukarıda, kırmızı ile gösterilen kısımları silinince geriye kalan kısım, şöyle olur:
- Bu bağları, zikzaklı bir şekilde çizersek, çizgi-bağ formülü tamamlanmış olur:
Öğretici Örnek:
Aşağıdaki örnekleri inceleyiniz:
Bazı Bileşiklerin Çizgi-Bağ Formülleri
Formül Bulma Problemleri
Bir organik bileşiğin formülünü bulmanın iki yolu vardır. Bu yollar şunlardır:
- Elementlerin miktarları belli ise:
- Bileşikteki her bir elementin teker teker mol sayısı hesaplanır.
- Hesaplanan mol sayıları genişletilerek/sadeleştirilerek tam sayıya çevrilir.
- Bulunan tam sayılar formülde, elementlerinin altına yazılır.
- Kimyasal tepkime denklemi verilir ya da tarif edilir ise:
- Tepkime denklemi yazılır.
- Tepkimedeki katsayılar tespit edilir.
- Denkleştirme kurallarına göre bileşiğin formülünü bulunur.
3. Doğada Karbon
- Karbon (C) elementi, periyodik sistemin:
- 14. grubunda veya 4A grubunda ve
- 2. periyotunda yer alan bir elementtir.
- Karbon elementi bir ametaldir.
- Canlılar için çok önemli bir elementtir.
- Yer yüzünde canlılık, C elementi üzerinden ortaya çıkmış ve devam etmektedir.
- Canlı organizmalardaki bileşikler, organik bileşiklerdir, yani karbon bileşikleridir.
- İnsan vücudunda, oksijenden sonra en çok bulunan element karbon elementidir.
- Karbon elementi, çok yetenekli bir elementtir.
- Tek başına, diğer bütün elementlerden daha çok sayıda bileşiği vardır.
- Bu yüzden, doğada karbon atomu, farklı şekillerde karşımıza çıkabilmektedir.
Karbon Atomunun Bağ Yapma Özelliği
- Karbon atomu, bağ kurma yeteneği yüksek olan bir atomdur.
- 4A grubunda bulunduğu için değerlik elektron sayısı 4’tür. Bu yüzden C atomu:
- Her zaman 4 tane kovalent bağ kurar.
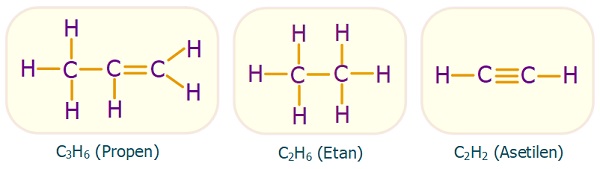
- Tekli, ikili ve üçlü kovalent bağlar kurabilir.
- Tekli, ikili ve üçlü kovalent bağ kurmuş C atomu örnekleri:
-
- Karbon atomunun tekli bağlarının bağ enerjileri yüksektir; bu yüzden bu bağlar sağlam bağlardır.
- İkili kovalent bağların bağ enerjileri, tekli bağlardan daha sağlamdır; üçlü bağların da ikili bağlardan daha sağlamdır. Yani; en sağlam kovalent bağlar, üçlü kovalent bağlardır.
Toplam 4 Tane Kovalent Bağ
- İster tekli kovalent bağ, ister ikili isterse de üçlü kovalent bağ olsun, bir karbon atomunun etrafındaki bağların toplamı her zaman 4 olmalıdır.
- Aşağıda bazı organik bileşiklerin açık formülleri verilmiştir. Her karbon atomunun etrafında her zaman toplam 4 tane kovalent bağ olduğuna dikkat edelim:
Karbon Atomunun Kovalent Bağları
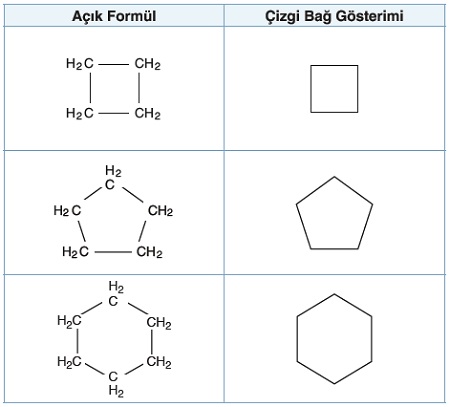
- Organik molekülün başındaki ve sonundaki C atomu birbirine bağlanırsa, halkalı (siklo) bir organik molekül oluşur.
- Siklo moleküllerin en küçük üyesi 3 karbonludur.
- 3 karbonlu halka bir üçgen şeklindedir, 4 karbonlu kare, 5 karbonlu beşgen, 6 karbonlu altıgen… şeklindedir.
- Aşağıda, bu tür organik bileşiklere örnekler verilmiştir:
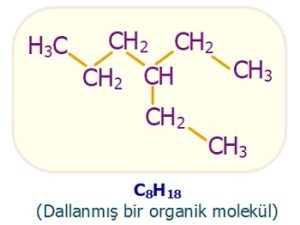
- Moleküldeki karbon atomlarını takip ederken, yol bir yerde ikiye ayrılıyorsa, böyle moleküllere dallanmış moleküller denir.
- Aşağıda, bazı dallanmış organik bileşiklere örnekler verilmiştir:
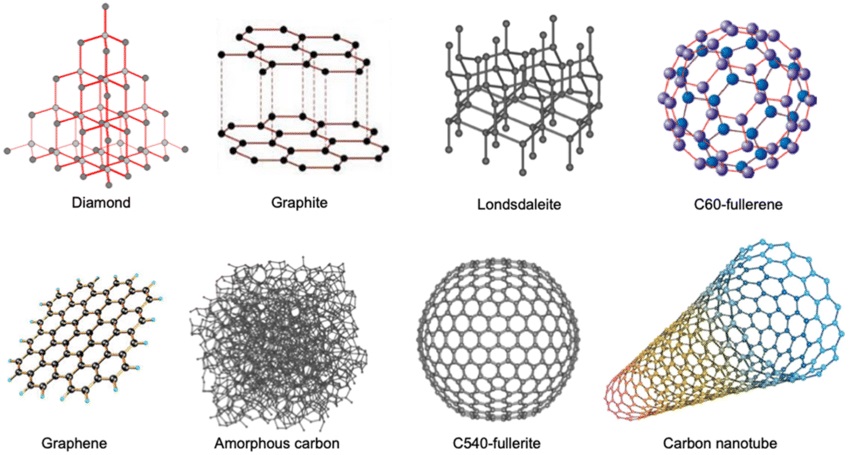
Karbon Atomunun Allotropları
- Aynı atomların farklı geometrik şekillerde dizilmesi ile ortaya çıkan maddelere allotrop maddeler denir.
- Birbiri ile allotrop olan maddeler, aslında aynı elementtirler.
- Allotropların fiziksel özellikleri ve bazı kimyasal özellikleri farklıdır.
- Aynı maddeler ile tepkime girdiklerinde aynı ürünleri oluştururlar.
- Kimyasal tepkimelere girme istekleri farklıdır.
- Karbon elementinin en bilinen allotropları şunlardır:
- Doğal olanlar:
- Elmas
- Grafit
- Yapay olanlar:
- Grafen
- Fullerenler (C60)
- Nanotüpler
- Doğal olanlar:
Aşağıda karbon elementinin allotroplarına ait molekül geometrileri verilmiştir:
Elmas
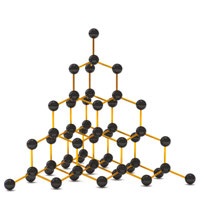
 Elmas Kristalinde C Atomları Elmas (Karbonun Allotropu)
Elmas Kristalinde C Atomları Elmas (Karbonun Allotropu)- Saydamdır.
- Elektriği iletmez.
- Isıyı iyi iletir.
- Karbon atomları:
- 4 tane tekli kovalent bağ kurmuştur.
- sp3 hibritleşmesi yapmıştır.
- Düzgün dörtyüzlü şeklinde dizilmiştir.
- Doğal maddeler içinde, en sertidir.
- İyi bir kesici ve aşındırıcıdır.
- 850 oC’de yanar, 3500 oC’de erir.
- Erime noktası grafitten daha yüksektir.
- Her elmasın kristalleri farklıdır.
- Kristal dizilimi birbirinin aynı olan 2 tane elmas yoktur.
- Grafitten, yapay olarak elde edilebilmektedir.
Grafit


Grafitteki Tabakalar Grafit (Karbonun Allotropu)
- Yağlıdır.
- Siyah-çelik rengi arası renktedir.
- Kağıt üzerinde iz bırakır.
- Yumuşaktır.
- Parlaktır.
- Mat bir katıdır.
- Elektrik akımın iletir.
- Kurşun kalemlerin ucu, kil karıştırılarak sertleştirilmiş grafittir.
- Grafit makine yağlayıcısı olarak da kullanılır.
- Elektrik motorlarında, lityum pillerde kullanılır.
- Yüksek sıcaklığa dayanıklı olduğu için, uzay araçlarında ısı kalkanı olarak kullanılır.
- Bir A4 destesindeki kağıtlar gibi, üst üste dizilmiş tabakalardan oluşur.
- Bu tabakaların her birine grafen denir.
- Bu tabakalar, düzgün altıgenler şeklinde birbirine bağlanmış karbon atomlarından oluşur.
- Grafen tabakalar arasında Van der Waals etkileşimleri etkilidir.
- Grafit, bir yüzeye sürtündüğünde, tabakalar arasındaki etkileşimler kopar ve en alttaki taba yüzeyde kalır, sonra sıradaki tabaka kalır… Bu şekilde, kurşun kalem kağıda yazmış olur.
Grafen
- Karbon elementinin yapay bir allotropudur.
- Grafiti oluşturan tabaklardan her biridir.
- Isı ve elektrik iletkenliği üst düzeydedir.
- Elektronik kağıt olarak da isimlendirilir.
- İki boyutlu ve saydam bir tabakdır.
- Çelikten 6 kat daha sert ve hafif, 13 kat daha esnektir.
Fullerenler (C60)
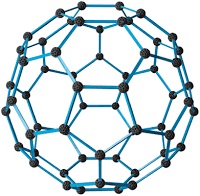 C60 Fullereni
C60 Fullereni- C elementinin yapay bir allotropudur.
- Fulleren adı, Richard Buckminster Fuller (1895-1983)’den almıştır.
- Top, tüp ve çubuk şeklinde olabilirler.
- Asal yapıda maddelerdir, kimyasal etkinlikleri yoktur.
- Atomlar; beşgen, altıgen veya yedigen şeklinde dizilebilirler.
- Bazı kullanım alanları şunlardır.
- Güneş pilleri
- Hidrojen yakıt depoları
- Kurşun geçirmez yelek yapımı
Nanotüpler
- Grafen tabakalarının tüp şeklinde yuvarlanması ile elde edilmektedir.
- Esnek ve sağlamdırlar.
- 1991 yılında Japon bilim insanı Sumi Lijima (Sumi Licima) tarafından keşfedilmişlerdir.
- Nano (10-9) teknolojinin gelişmesinde önemli yer tutarlar.
- Çok düşük sıcaklıklarda bile elektrik akımını ilettikleri için, “süper iletken”dirler.
- Bazı kullanım alanları şunlardır:
- Biyosensör yapımı
- Nanoteknoloji
- Dokunmatik ekranları
- Taramalı, tünelleme mikroskopları
- Organik güneş pilleri
- Hidrojen pilleri
4. Lewis Formülleri
Lewis Formülleri, daha önce Kimya 9 dersinde ve “Kimyasal Türler Arası Etkileşimler” ünitesine karşımıza çıkmıştı. Bu ünitede, atomların ve bir çok molekülün Lewis Nokta Yapılarını göstermeyi öğrenmiştik. Bu ders, bu ünitede öğrendiğimiz Lewis Nokta Yapılarını‘nın, daha çok organik moleküller üzerinde bir uygulaması gibi olacaktır.
Kimya 9 dersinde gördüğümüz Lewis Nokta Yapıları ile ilgili eksiğiniz varsa, konuyu tekrar etmek için aşağıdaki dersi tekrarlamalısınız:
- Lewis Elektron Nokta Yapısı
- Lewis Elektron Nokta Yapısı ile Kovalent Bağ Gösterimi
Organik Moleküllerin Lewis Nokta Yapıları
- Moleküller, kovalent bağ kurarak bir arada duran atomlardır.
- Kovalent bağ, ametaller arasında kurulan bir güçlü etkileşimdir.
- Organik bileşikler, kovalent bağlı bileşiklerdir.
- Bu yüzden, organik bileşikler moleküllerden oluşur.
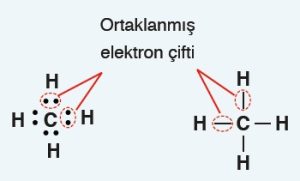
- Lewis Elektron Nokta Yapısı‘nda, atomun sembolünün etrafına, son yörüngedeki (değerlik) elektron sayısı kadar nokta konulur.
- Aynı kenarda bulunan iki noktayı, bir çizgi ile gösterme hakkımız vardır, dilersek kullanırız, dilersek kullanmayız.
- Organik moleküllerde karşımıza çıkacak ametaller genellikle şunlardır:
- C (Karbon)
- H (Hidrojen)
- O (Oksijen)
- N (Azot)
- F (Flor)
- Cl (Klor)
- Br (Brom)
- I (İyot)
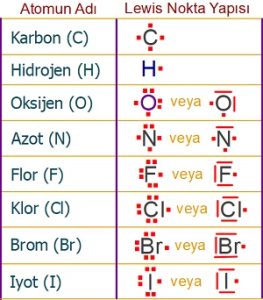
Bu ametallerin elektron dizilimleri ve Lewis yapıları şöyledir:
Organik bileşiklerde karşımıza çıkabilecek ametallerin elektron dağılımları şöyledir:
6C6 )2e– )4e–
1H1 )1e–
8O8 )2e– )6e–
7N7 )2e– )5e–
9F9 )2e– )7e–
17Cl17 )2e– )8e– )7e–
35Br35 2e– 8e– 18e– 7e–
53I53 2e– 8e– 18e– 18e– 7e–
Bu ametallerin Lewis Elektron Nokta Yapısı şöyledir:
- Organik moleküllerin Lewis Nokta Yapılarını yazmak için, Kovalent Bağlı Moleküllerin Lewis Nokta Yapılarına ait kuralları kullanırız.
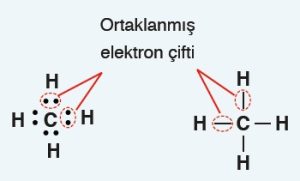
- Kovalent bağ, Lewis yapısındaki yalnız noktalar ile kurulur.
- Kovalent bağ kurulurken atomlar yalnız noktalarını (elektronlarını) ortaklaşa kullanır.
- İki ametal atomu, birer yalnız noktasını ortaya koyar ve bir kovalent bağ oluşur.
- Bir atomun, Lewis yapısında, kaç tane yalnız nokta varsa o sayıda kovalent bağ kurar.
Ametalleri, organik moleküllerde, aşağıdaki gibi kovalent bağlar kurarken görürüz:
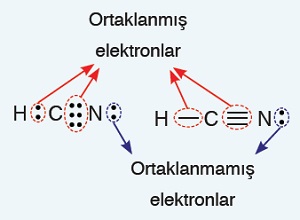
- C: 4 tane kovalent bağ yapar ve oktetini tamamlar. Lewis yapısındaki bütün elektronlar kovalent bağa katılır.
- H: 1 tane elektronu vardır ve onunla kovalent bağ yapar ve dubletini tamamlar.
- O: 2 tane kovalent bağ yapar ve oktetini tamamlar. 2 çift elektronu bağa katılmaz.
veya
- N: 3 tane kovalent bağ yapar ve oktetini tamamlar. 1 çift elektronu bağa katılmaz.
- F, Cl, Br ve I: 1 tane kovalent bağ yaparlar ve oktetlerini tamamlarlar. 3 çift elektronları bağa katılmaz.
- Kovalent bağa katılan elektronlara, “ortaklanmış elektronlar” denir.
- Ortaklaşa kullanılmayan yani; kovalent bağa katılmayan elektronlara “ortaklanmamış elektronlar” denir.
Bazı Organik Moleküllerin Lewis Nokta Yapıları
HATIRLA:
- Kovalent bağ demek ortaklaşa kullanılan iki değerlik elektronu demektir.
- Bir kovalent bağdaki iki elektron:
- İki nokta ile de gösterilebilir.
- Kısa bir çizgi ile de gösterilebilir.
- Yapı formüllerinde, kovalent bağlardaki elektron çiftleri kısa çizgilerle gösterilirler.
Hibritleşme ve Molekül Geometrisi
- Hibritleşme, “melezleşme” demektir.
- Hibritleşme olayı, atomların orbitallerinde gerçekleşir.
- Hibritleşme olayına, sadece son yörüngedeki orbitaller (değerlik orbitalleri) katılır.
- Hibritleşme olayında, son yörüngedeki orbitaller melezleşir ve hibrit orbitallerine dönüşür.
- Hibrit orbitalleri, eşit enerjili kardeş orbitallerdir.
- Hibrit orbitallerinin şekilleri, bildiğimiz s, p, d, f orbitallerinden farklıdır.
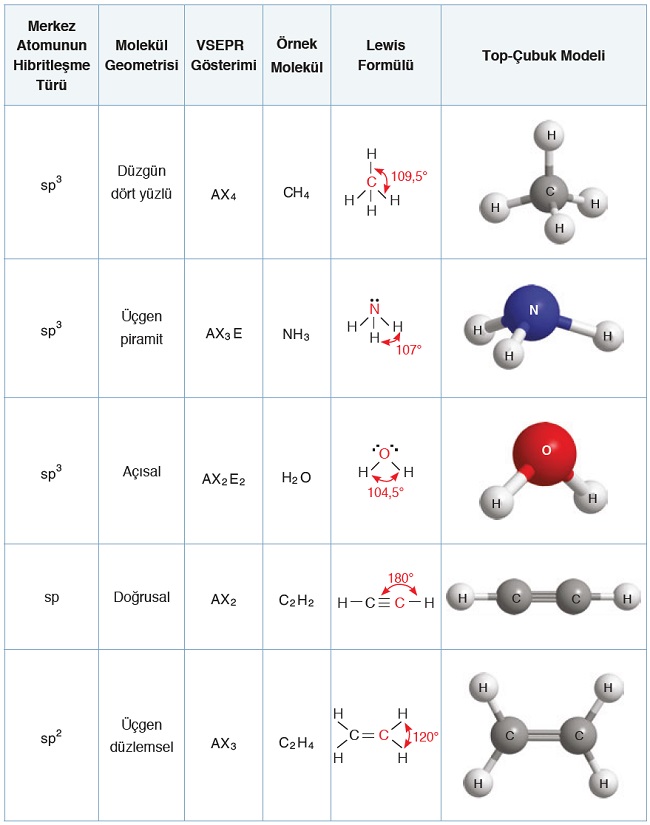
- Organik moleküllerde karşımıza çıkabilecek üç çeşit hibritleşme vardır. Bunlar:
- sp3 hibritleşmesi (1 tane s, 3 tane p orbitali hibritleşir.)
- sp2 hibritleşmesi (1 tane s, 2 tane p orbitali hibritleşir.)
- sp hibritleşmesi (1 tane s, 1 tane p orbitali hibritleşir.)
- Hibrit orbitallerinin kendilerine özgü isimleri vardır:
- sp3 hibrit orbitalleri (4 kardeş orbitaldir.)
- sp2 hibrit orbitalleri (3 kardeş orbitaldir.
- sp hibrit orbitalleri (2 kardeş orbitaldir.)
- Hibritleşmenin türü atomun kuracağı σ (sigma) ve π (pi) bağlarının sayısını belirler.
σ (Sigma) ve π (Pi) Bağları
- Kovalent bağlar, şu şekilde ikiye ayrılır.
- σ (Sigma) bağı
- π (Pi) bağları
σ (Sigma) Bağı
- İki ametal arasında kurulan ilk kovalent bağ sigma bağıdır.
- Sigma bağı yoksa, atomlar kovalent bağ kurmamış demektir.
- İki tane yarı dolu orbitalin kesişmesi ile bir sigma bağı oluşur.
Karbon atomunun sigma bağları, hibrit orbitalleri ile kurulur.
π (Pi) Bağı
- Pi bağı, ikili veya üçlü kovalent bağlarda görülür.
- İkili kovalent bağın, bir tanesi sigma diğeri pi bağıdır.
- Üçlü kovalent bağın, bir tanesi sigma, diğer ikisi pi bağlarıdır.
Karbon atomunda hibritleşmeye katılmayan yarı dolu orbitaller, pi bağı oluşturur.
Hibritleşme Türüne Göre Sigma ve Pi Bağı Sayısı
Karbon atomunun kurduğu kovalent bağların türleri şöyle tespit edilir:
- sp3 hibritleşmesi yapan C atomu, 4 tane sigma bağı kurar, hiç pi bağı kurmaz.
- sp2 hibritleşmesi yapan C atomu, 3 tane sigma bağı kurar, 1 tane pi bağı kurar.
- sp hibritleşmesi yapan C atomu, 2 tane sigma bağı kurar, 2 tane pi bağı kurar.
Öğretici örnek:
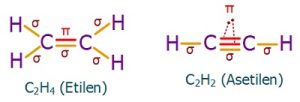
Aşağıda, etilen ve asetilen molekülündeki bağların, nasıl sigma ve pi olarak sınıflandırıldığını görüyorsunuz:
Öğretici Örnek:
Aşağıdaki organik molekülde belirtilen, σ (sigma) ve π (pi) bağlarını inceleyiniz.
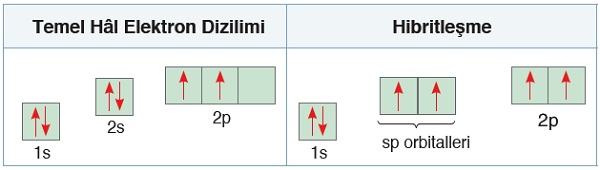
C Atomunun Temel Hal Orbitalleri
- C atomu, 6 proton ve 6 elektronu olan küçük ve yetenekli bir atomdur.
- C atomunun orbital dizilimi şu şekildedir:
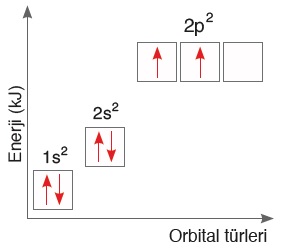
- 6C6 1s2 2s2 2p2
- C atomunun, hibritleşmeden önce, temel haline ait, enerji seviyeleri ile birlikte orbital dizilimini göstermek istersek, şöyle gösterebiliriz:
Hibritleşmeden önce, s ve p orbitalleri şöyle görünür:
- Temel hal orbital dizilimine bakarsak, 2p orbitallerinin enerjisinin en yüksek olduğunu, 2s orbitallerinin enerjisinin de 2p orbitallerinden düşük olduğunu görürüz.
- C atomunun değerlik orbitalleri, 2s2 ve 2p2 orbitalleri olduğu için, hibritleşme bu iki orbital arasında gerçekleşir.
C Atomunun sp3 Hibritleşmesi
- C atomunda sp3 hibritleşmesi, atomun son yörüngesinde bulunan; 2s orbitali ile 3 tane kardeş 2p orbitalinin melezleşmesi ile oluşur.
- Hibritleşme gerçekleşmeden önce;
- uyarılma gerçekleşir ve
- 2s elektronlarından biri boş 2p orbitaline sıçrar.
- sp3 hibritleşmesinde;
- 2s orbitalinin enerjisi biraz artar
- 2p orbitallerinin üçünün de enerjisi biraz azalır
- Böylece 4 tane orbital ortada buluşur ve enerjileri eşitlenir
- Bu arada, 2s2 orbitalinin 1 elektronu boş olan 2p2 orbitallerine geçer.
- Bu olaylar sonucu, C atomu temel halden sp3 hibritleşmesi yapmış hale geçer.
- sp3 hibrileşmesi esnasında gerçekleşen bütün bu olaylar şu şekilde gösterilebilir:
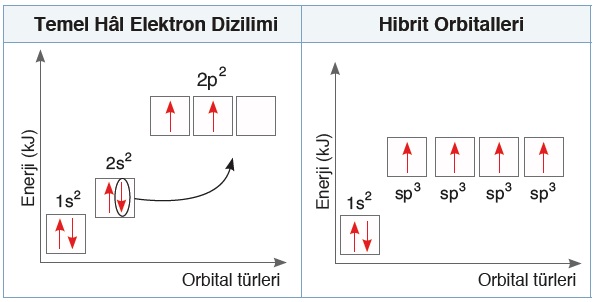
- Yukarıda görüldüğü gibi, sp3 hibrit orbitalleri, 4 tane yarı dolu orbitaldir.
- sp3 hibrit orbitalleri; biri sönük diğeri şişik iki tane balonun ağızlarından eklenmesiyle oluşan şekler benzer.
- Aşağıda, 4 adet sp3 hibrit orbitali, yönleri ile birlikte verilmiştir:
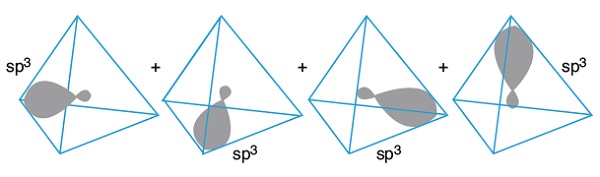
- Atomun çekirdeğinin etrafında, 4 tane sp3 hibrit orbitali, hep birlikte şöyle görünür:
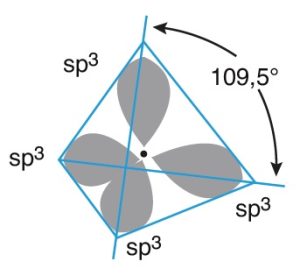
sp3 Hibritleşmesi Yapmış C Atomunun Özellikleri
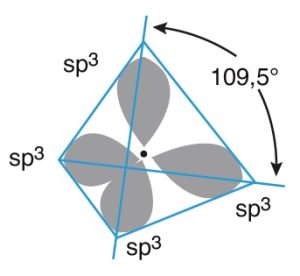
- sp3 orbitallerin hep birlikte oluşturduğu şekle bakarsak, eş üçgenlerden oluşan bir üçgen piramittir.
- Bu şekle düzgün dörtyüzlü denir.
- Kovalent bağlar arasındaki açı 109,5 derecedir.
- C atomu ile kovalent bağ kurmak isteyen atomlar, bu 4 tane hibrit orbitali ile kesişerek bağlanırlar.
- Yani; karbon atomuna bağlanacak atomlar, bu orbitallerin elektronlarını ortaklaşa kullanır.
- sp3 hibritleşmesi yapmış C atomu, 4 tane tekli kovalent bağ kurar.
- Tekli kovalent bağların hepsi σ (sigma) bağıdır:
- Bu karbon atomunun oluşturduğu moleküllerin geometrik şekli, düzgün dörtyüzlüdür.
- Çizim zorluğundan dolayı dik açılı gibi çizilir fakat; kovalent bağlar arasındaki açı 109,5 derecedir.
- İkili veya üçlü kovalent bağ yapmayan bütün C atomları sp3 hibritleşmesi yapmış demektir.
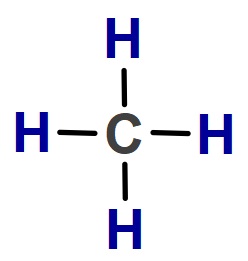
CH4 (Metan) Molekülü
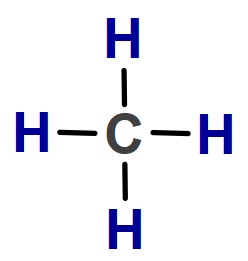
- CH4 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomunun 4 tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- CH4 molekülündeki C atomu sp3 hibritleşmesi yapmıştır.
- CH4 molekülünün geometrik şekli düzgün dörtyüzlüdür.
- CH4 molekülünde, bağlar arasındaki açı 109,5 derecedir.
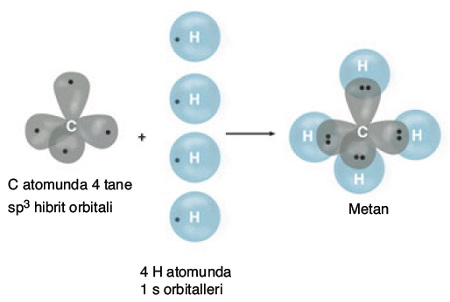
Aşağıda, orbitaller yapıları ile, CH4 molekülünün oluşumu verilmiştir:
CCl4 (Karbon Tetraklorür) Molekülü
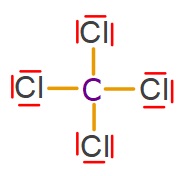
- CCl4 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomunun 4 tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- CCl4 molekülündeki C atomu sp3 hibritleşmesi yapmıştır.
- CCl4 molekülünün geometrik şekli düzgün dörtyüzlüdür.
- CCl4 molekülünde, bağlar arasındaki açı 109,5 derecedir.
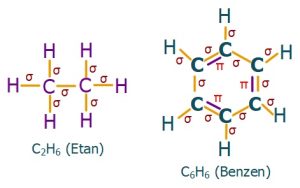
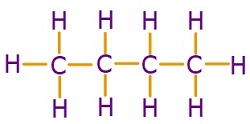
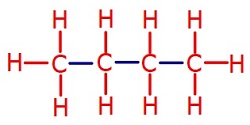
C2H6 (Etan) Molekülü
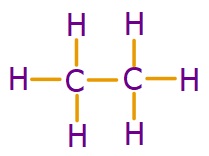
- C2H6 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomlarının ikisinin de 4’er tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- C2H6 molekülündeki 2 C atomu da sp3 hibritleşmesi yapmıştır.
- C2H6 molekülünün geometrik şekli, birbirine eklenmiş 2 tane düzgün dörtyüzlüdür.
- C2H6 molekülünde, bağlar arasındaki açı 109,5 derecedir.
C2H6 molekülünün orbital yapısı şöyledir:
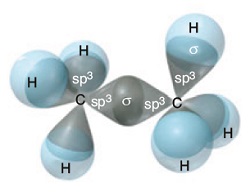
C Atomunun sp2 Hibritleşmesi
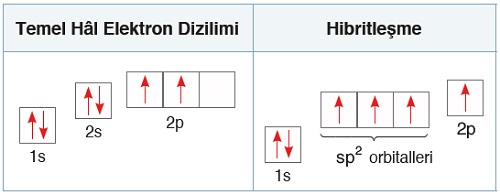
- sp2 hibritleşmesinde; s orbitali ve kardeş p orbitallerinden 2 tanesi hibritleşmeye katılır, geriye kalan 1 tane p orbitali hibritleşmeye katılmaz. Yani; sp2 hibritleşmesine toplam 3 tane orbital katılır.
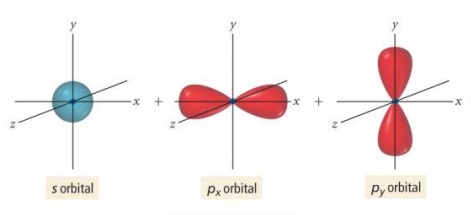
- s orbitali; sp3 hibritleşmesinde olduğu gibi bir elektronunu, boş olan p orbitaline verir.
- s orbitali ile 2 tane yarı dolu kardeş p orbitali, aynı enerji düzeyinde buluşur. (sp3 hibritleşmesinde olduğu gibi)
- sp2 hibritleşmesi sonucu, 3 tane sp2 hibrit orbitali oluşur.

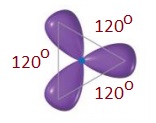
- sp2 hibrit orbitalleri, atomun çekirdeğinden dışarıya doğru yönelen ve aralarında 120o açı olan 3 adet eş orbitaldir.
sp2 Hibritleşmesi Yapmış C Atomunun Özellikleri
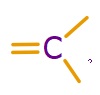
- sp2 hibritleşmesi yapmış C atomu, 2 tane tekli 1 tane ikili kovalent bağ kurar.
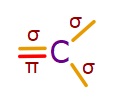
- İkili kovalent bağlarının biri σ (sigma); diğeri π (pi) bağıdır.
- Tekli kovalent bağların ikisi de σ (sigma) bağıdır:
- sp2 hibritleşmesi yapmış C atomunun bağları arasındaki açı 120o‘dir.
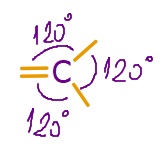
- Bu karbon atomunun oluşturduğu molekülleri geometrik şekli, düzlem üçgendir.
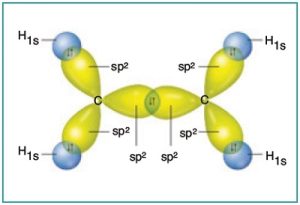
C2H4 (Etilen) Molekülü
Etilen, diğer adıyla eten molekülündeki C atomlarının ikisi de sp2 hibritleşmesi yapmıştır. Moleküle yakından bakalım:
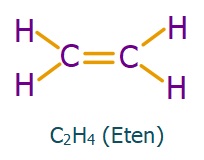
- Etilen molekülündeki σ (sigma) ve π (pi) bağları şöyledir:
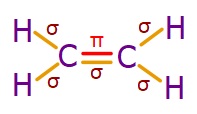
- C-H bağlarının her biri bir σ (sigma) bağıdır.
- sp2 hibrit orbitalleri 3 tanedir ve hepsi σ (sigma) bağı kurmak için kullanılır.
- C atomları, 3’er tane σ (sigma) bağlarını sp2 hibrit orbitalleri ile yapar.
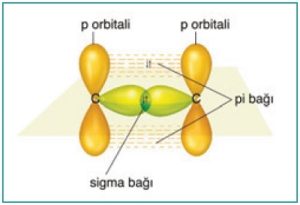
- sp2 hibritleşmesine katılmayan p orbitali ise π (pi) bağı kurmak için kullanılır.
- C-H bağındaki elektronların biri H atomunun yarı dolu s orbitalinden, diğeri de C atomunun sp2 hibrit orbitalinden gelir.
- C=C atomları arasındaki σ (sigma) bağının elektronları, bu atomların yarı dolu birer sp2 hibrit orbitalinden gelir.
- C=C arasındaki π (pi) bağı ise, C atomlarının sp2 hibritleşmesine katılmayan p orbitallerinin ortaklaşması ile oluşur.
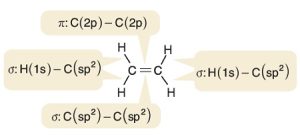
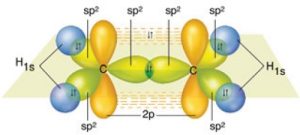
- Orbital yapısı ile C2H4 (Etilen) molekülünündeki sigma bağlarını şöyle gösterebiliriz:
- Orbital yapısı ile C2H4 (Etilen) molekülünündeki pi bağını şöyle gösterebiliriz:
- Orbital yapısı ile C2H4 (Etilen) molekülünündeki sigma ve pi bağlarını, hep birlikte şöyle gösterebiliriz:
C Atomunun sp Hibritleşmesi
- sp hibritleşmesinde; s orbitali ve kardeş p orbitallerinden 1 tanesi hibritleşmeye katılır, geriye kalan 2 tane p orbitali hibritleşmeye katılmaz. Yani; sp hibritleşmesine toplam 2 tane orbital katılır.
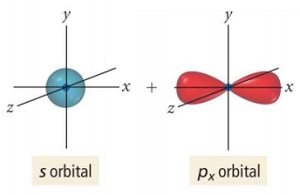
- s orbitali; önceki hibritleşme türlerinde olduğu gibi bir elektronunu, boş olan p orbitaline verir.
- s orbitali ile 1 tane yarı dolu kardeş p orbitali, aynı enerji düzeyinde buluşur.
- sp hibritleşmesi sonucu, 2 tane sp2 hibrit orbitali oluşur.

- sp2 hibrit orbitalleri, atomun çekirdeğinden dışarıya doğru yönelen ve aralarında 120o açı olan 3 adet eş orbitaldir.
sp Hibritleşmesi Yapmış C Atomunun Özellikleri
- sp hibritleşmesi yapmış C atomu:
- 2 tane ikili kovalent bağ veya
- 1 tane tekli 1 tane üçlü kovalent bağ kurar.

- İkili kovalent bağlarının biri σ (sigma); diğeri π (pi) bağıdır.
- Üçlü kovalent bağlarının biri σ (sigma); diğer ikisi π (pi) bağıdır.
- Tekli kovalent bağ, σ (sigma) bağıdır:

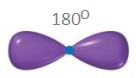
- sp hibritleşmesi yapmış C atomunun bağları arasındaki açı 180o‘dir.

- Bu karbon atomunun oluşturduğu molekülleri geometrik şekli, doğrusaldır.
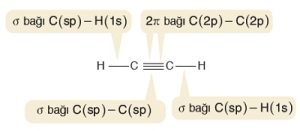
C2H2 (Asetilen veya Etin) Molekülü
- Etin, diğer adıyla asetilen molekülündeki C atomlarının ikisi de sp hibritleşmesi yapmıştır. Moleküle yakından bakalım:

- Etilen molekülündeki σ (sigma) ve π (pi) bağları şöyledir:
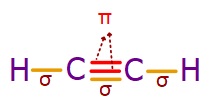
- C-H bağlarının her biri bir σ (sigma) bağıdır.
- sp hibrit orbitalleri 2 tanedir ve hepsi σ (sigma) bağı kurmak için kullanılır.
- C atomları, 2’şer tane σ (sigma) bağlarını sp hibrit orbitalleri ile yapar.
- sp hibritleşmesine katılmayan p orbitalleri ise 2 tane π (pi) bağı kurmak için kullanılır.
- C-H bağındaki elektronların biri H atomunun yarı dolu s orbitalinden, diğeri de C atomunun sp hibrit orbitalinden gelir.
- C C atomları arasındaki σ (sigma) bağının elektronları, bu atomların yarı dolu birer sp hibrit orbitalinden gelir.
- C C atomları arasındaki π (pi) bağları ise, C atomlarının sp hibritleşmesine katılmayan p orbitallerinin ortaklaşması ile oluşur.
- Orbital yapısı ile C2H2 (Asetilen) molekülünündeki sigma bağlarını şöyle gösterebiliriz:
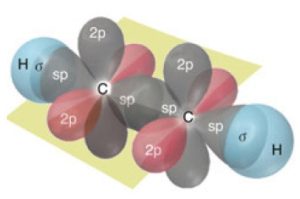
- Orbital yapısı ile C2H2 (Asetilen) molekülünündeki pi bağlarını şöyle gösterebiliriz:
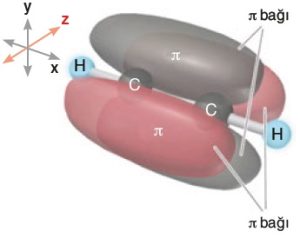
VSEPR Yaklaşımı ve Molekül Geometrisi
Karbon (C) atomunun, bütün hibritleşme türlerini detaylı bir şekilde gördük. Peki; diğer atomlarda hibritleşme olmaz mı? Olursa, hangi hibritleşmeler olur ve bu atomların molekülleri neye benzer? Bu soruların cevabını VSEPR kuralı verir.
- VSEPR: Değerlik Katmanı Elektron Çifti İtmesi (Valance Shell Electron Pair Repulsion)
- Atomların hibritleşmeye katılan orbitalleri her zaman yarı dolu olmayabilir.
- 5A ve 6A atomlarının tam dolu bir değerlik orbitali de sp3 hibritleşmesine katılır.
- Hibritleşmeye katılan bu orbitaller tam dolu oldukları için bağa katılmadan ayrı dururlar.
- Bu orbitaller, bağ kuran orbitalleri (elektron çiftlerini) iterler. (Elektronlar arası itme)
- Bu durum bağ kuran orbitallerin birbirine yaklaşmasına sebep olur ve bağ açılarını küçültür.
- Bu da molekül geometrisini etkiler.
- VSEPR kuralı, bağa katılmayan hibrit orbitallerinin, molekül geometrisine etkisini açıklar.
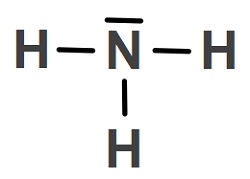
N (Azot) Atomunun Hibritleşmesi (sp3)
- N atomunun 7 tane protonu ve temel halde 7 tane elektronu vardır.
- N atomunun temel hal orbital dizlimi şöyledir:
- 7N7 1s2 2s2 2p3
- N atomu, sp3 hibritleşmesi yapar. Hibritleşme olayı şöyle gerçekleşir:
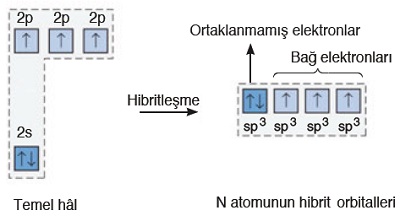
- Hibrit orbitallerine bakarsak, 4 tane sp3 hibrit orbitali görürüz. Bu orbitallerin:
- 1 tanesi tam doludur:
- Bağa katılmazlar, bağ orbitallerini iterek kendinden uzaklaştırır.
- 3 tanesi yarı doludur:
- Diğer atomların (mesela H atomlarının) yarı dolu değerlik orbitalleri ile örtüşerek 3 tane sigma bağı yaparlar.
- 1 tanesi tam doludur:
- NH3 molekülünün orbital yapısına bakarak, N atomunun hibritleşmiş halini, molekülünde iken görelim:
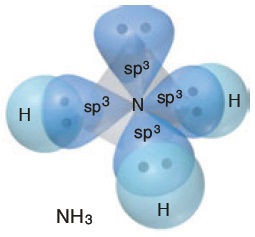
- N atomunda, bağa katılmayan hibrit orbitalinin bağları iterek, molekül geometrisini nasıl etkilediğini aşağıda şekilde daha net görüyoruz:
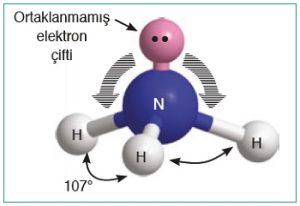
- 5A grubu atomlarının (N gibi) H veya halojenler ile yaptığı moleküller:
- Üçgen Piramit bir geometrik şekle sahiptir.
- Bu tür moleküllerde, bağ açısı 107o‘dir.
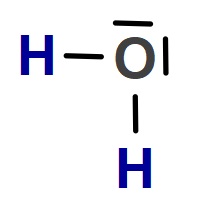
O (Oksijen) Atomunun Hibritleşmesi (sp3)
- O atomunun 8 tane protonu ve temel halde 8 tane elektronu vardır.
- O atomunun temel hal orbital dizlimi şöyledir:
- 8O8 1s2 2s2 2p4
- O atomu, sp3 hibritleşmesi yapar. Hibritleşme olayı şöyle gerçekleşir:
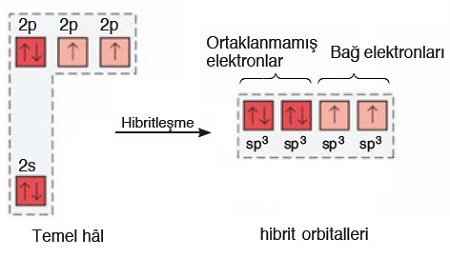
- Hibrit orbitallerine bakarsak, 4 tane sp3 hibrit orbitali görürüz. Bu orbitallerin:
- 2 tanesi tam doludur:
- Bağa katılmazlar.
- Bağ orbitallerini ve birbirlerini iterek molekül geometrisini etkilerler.
- 2 tanesi yarı doludur:
- Diğer atomların (mesela H atomlarının) yarı dolu değerlik orbitalleri ile örtüşerek 2 tane sigma bağı yaparlar.
- 2 tanesi tam doludur:
- H2O molekülünün orbital yapısına bakarak, O atomunun hibritleşmiş halini, molekülünde iken görelim:
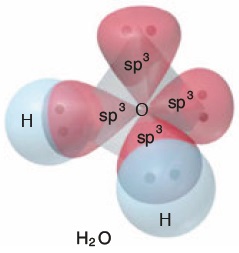
- O atomunda, bağa katılmayan 2 tane sp3 hibrit orbitalinin bağları iterek, molekül geometrisini nasıl etkilediğini aşağıda şekilde daha net görüyoruz:
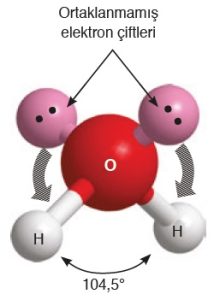
- 6A grubu atomlarının (oksijen gibi), H veya halojenler ile yaptığı moleküller:
- Kırık Doğru (Açısal) bir geometrik şekle sahiptir.
- Bağ açıları 104,5o‘dir.
Moleküllerin VSEPR Formülleri
- VSEPR kuralına göre, molekülün VSEPR formülü bulunursa, hibritleşme türü ve molekül geometrisi de bulunabilir.
- Bir molekülün VSEPR formülü şu şablona göre yazılır:
AXnEm
- Bu formüldeki sembollerin anlamı şudur:
- A: Molekülün Merkez atomunu temsil eder. Bir molekülün merkez atomu, genelde sayısı az olan atomdur.
- X: Molekülün merkez atomuna bağlı diğer atomları temsil eder.
- n: Molekülün merkez atomuna bağlı diğer atomların sayısıdır.
- E: Molekülün merkez atomunun, bağa katılmayan elektron çiftlerini temsil eder.
- m: Molekülün merkez atomunun, bağa katılmayan elektron çiftlerinin sayısıdır. (Dikkat edin; elektron sayısı değil, elektorn çiftlerinin sayısıdır.)
Aşağıda, şu ana kadar öğrendiğimiz atom ve moleküllere dair bilgiler özetlenmiştir. Bu tablo dikkatle incelenmelidir.







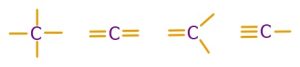
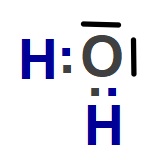 veya
veya