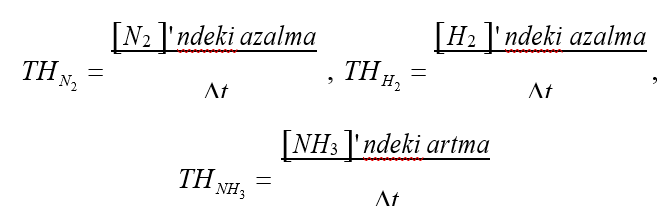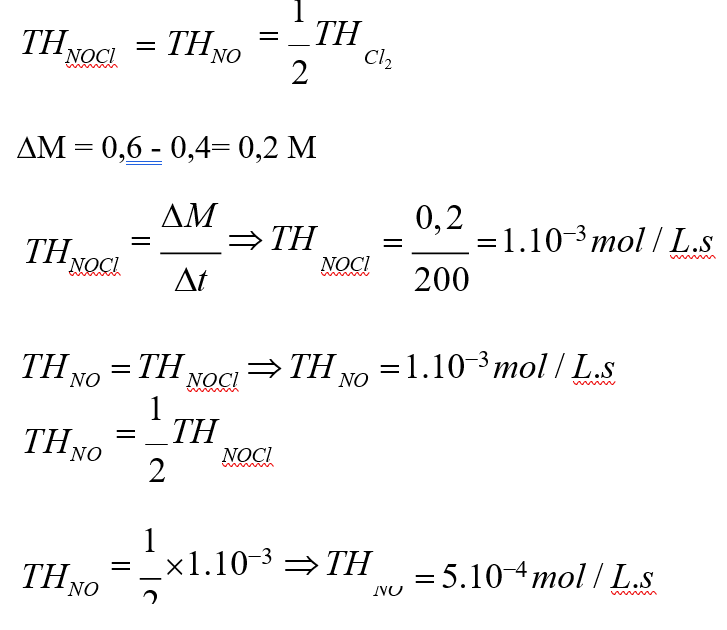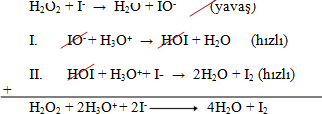Kimyasal Tepkimelerde Hız Konu Anlatımı
Kimyasal tepkimelerin ne kadar sürede gerçekleştiğini bilmek, günlük yaşantımızda oldukça önemlidir. Metallerin paslanmasının önlenmesi odun, kömür gibi yanıcı maddelerin hangi ortamlarda güvenle saklanabileceğinin bilinmesi, bu olayların hızlarının ölçülebilmesi ve kontrol edilebilmesi ile mümkündür.
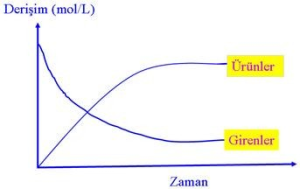
Bir kimyasal olayda, olaya giren maddeler zaman içinde tükenirken olaydan çıkan ürünler artar. Bazı kimyasal olaylarda olaya girenler (reaktifler) hızlı azalırken bazı olaylarda yavaş azalır. Günlük yaşamımızda gözlemlediğimiz birçok olayda bunu görmek mümkündür. Toz Şeker, kesme Şekerden daha çabuk suda çözünür. Benzin, kömürden daha çabuk yanar. Kimyasal reaksiyonların hızlarını ölçen, mekanizmalarını inceleyen kimya dalına
kimyasal kinetik denir.
1.1. Tepkime Hızlarının İncelenmesi
A(g) + B(g) → C(g) + D(g) gibi kimyasal tepkimelerde, tepkime süresince girenlerin miktarı azalırken ürünlerin miktarı artar. Bu artma ve azalma ne kadar hızlı oluyorsa tepkime de o kadar hızlıdır.
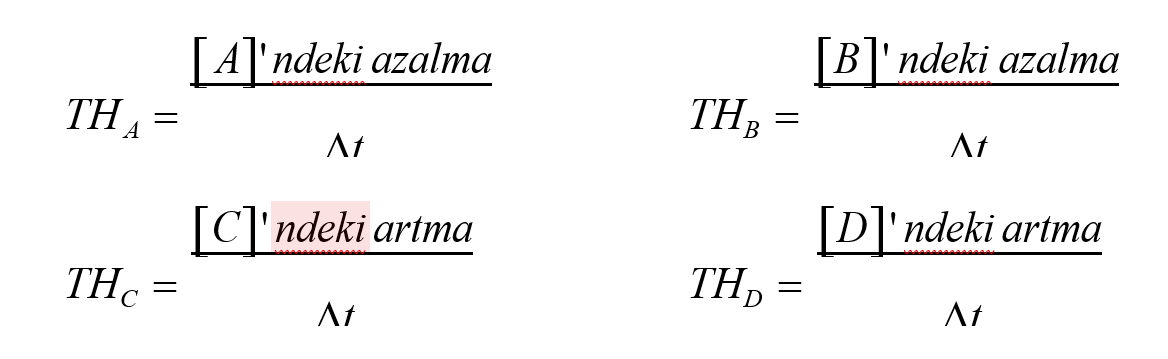
Tepkime hızı (TH), birim zamanda madde miktarındaki değişmedir .Madde miktarı olarak gram, mol ve en çok da molar derişim alınır.
Tepkimehızı = Maddederişimindeki azalma
Zamanaralığı
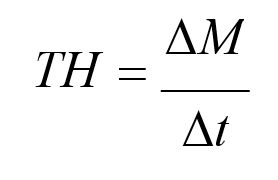
Burada ∆M, molar derişimdeki değişme; ∆t, zamandaki değişmedir.
A(g) + B(g) → C(g) + D(g) tepkimesinde hız bağıntısı girenler ve ürünler türünden ayrı ayrı yazılabilir.
Tepkime denkleminde bütün maddelerin kat sayıları eĢit olduğundan hız bağıntıları arasında,
THA = THB = THC = THD eşitliği yazılabilir. Ancak bu eşitlik her zaman mümkün olmaz.
Örneğin;
N2(g) + 3H2(g) → 2NH3(g) tepkimesinin hızı, girenlerin derişimindeki azalma ve ürünlerin derişimindeki artma türünden yazılırsa;
Tepkime denklemindeki kat sayılardan N2nin tükenme hızı, H2nin tükenme hızının 1/3’ü ve NH3ün oluşma hızının ½’si olduğu görülmektedir.
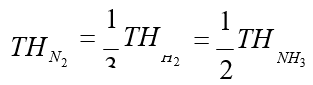
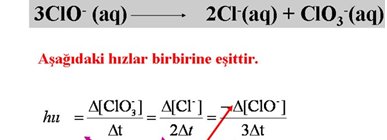
Örnek: 2NOCl(g) 2NO(g) + Cl2(g) tepkimesine göre NOCl’nin derişimi 200 saniyede 0,6 mol/L’den 0,4 mol/L’ye düştüğüne göre NO ve Cl2 gazlarının ortalama oluşma hızları kaç mol/L sn.dir?
Çözüm
1.2. Tepkime Hızının Ölçülmesi
Tepkime gerçekleşirken seçilecek zaman aralığı, tepkimenin niteliğine göre değişir. Yavaş yürüyen tepkimelerde büyük zaman aralığı, hızlı yürüyen tepkimelerde küçük zaman birimleri kullanılır. Örneğin; patlama ile gerçekleşen tepkimelerde mikro saniye, beyaz fosforun havada kendiliğinden tutuşarak yanmasında saniye, kömürün yanmasında dakika, demirin paslanmasında gün, uygun zaman birimleridir.
Tepkime hızlarını izleyebilmek için değişen bir özellik göz önüne alınır. Örneğin; basınç, hacim, renk, iletkenlik ve çökelme gibi özelliklerdeki değişmelere bakılarak tepkime hızı ölçülebilir.
Renk değişiminden hız ölçme
Bir tepkimede renk değişimi oluyorsa bu tepkimenin hızı renk değişiminden ölçülür. Renk ne kadar hızlı değişiyorsa tepkime de o kadar hızlı oluyor demektir.
C3H6(g) + Br2(g) = C3H6Br2(suda)
Renksiz Koyu kahverengi Renksiz
tepkimesinde renk ne kadar hızlı açılıyorsa tepkime o kadar hızlı oluyor demektir.
Elektrik iletkenliğinin artması ya da azalması ile hız ölçme
Bir tepkimede iyonlar oluşuyorsa zamanla iletkenlik artar; iyonlar kayboluyorsa iletkenlik düşer. Ortamda iyon olan tepkimelerde hız iletkenliğin değişmesinden takip edilir.
Ag+ (suda) + Cl-(suda) → AgCl(katı) tepkimesinde iletkenlik zamanla azalır.
Basınç ya da hacim değişiminden hız ölçme
Tepkimeye girenler gaz ise kapalı bir kapta basınç değişebilir ya da hareketli pistonu olan bir kapta hacim artabilir ya da azalabilir. Burada gazları saymak gerekir mol sayısı artan bir tepkime ise zamanla kapalı bir kapta basınç artar. Örneğin;
C2H6(gaz) + 7/2 O2(gaz) 2 CO2(gaz) + 3 H2O(sıvı) tepkimesinde zamanla basınç azaldığı için de hız da azalır.
Çökelek oluşumundan hız ölçme
Pb(NO3)2 + 2KI PbI2 + 2KNO3
Tepkimesinde çöken maddeye ve çökme hızına bakılarak hız ölçülebilir.
1.3. Çarpışma Teorisi
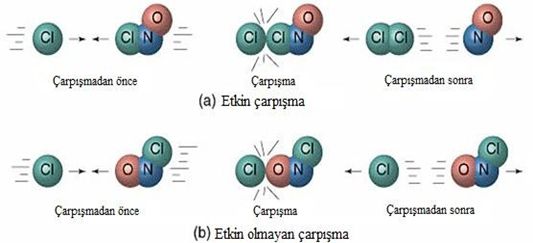
Bir kimyasal tepkimenin oluşabilmesi için tepkimeye giren taneciklerin (atom, iyon veya moleküllerin) birbirleriyle çarpışması gerekir. Tepkimelerin, taneciklerin çarpışmasıyla gerçekleştiğini varsayan teoriye çarpışma teorisi denir. Ancak her çarpışma her zaman tepkimeyle sonuçlanamaz. Çarpışmaların tepkimeyle sonuçlanabilmesi için çarpışan taneciklerin yeterli enerji ve uygun doğrultuda olmaları gerekir. Bu tür çarpışmalara etkin çarpışma denir. Tanecikler yeterli enerji ve uygun doğrultuda değiller ise çarpışma tepkime ile sonuçlanmaz. Bu tür çarpışmalara da etkin olmayan çarpışma denir.
2NOCl = 2NO + Cl2 tepkimesinde çarpışma olasılıkları,
(a) Uygun doğrultuda çarpışma (etkin çarpışma)
(b) Uygun olmayan doğrultuda çarpışma (etkin olmayan çarpışma)
1.4. Aktifleşme Enerjisi
Çarpışma teorisine göre kimyasal tepkimenin gerçekleşmesi için belirli kinetik enerjiye sahip taneciklerin uygun doğrultuda etkin çarpışma yapmaları gerekir. Taneciklerin çarpışarak ürüne dönüşebilmesi için gerekli olan minimum enerjiye eşik enerjisi ya da aktifleşme enerjisi denir. Aktifleşme enerjisi Ea sembolü ile gösterilir. Birimi kcal (kilo kalori) dir.
Aktifleşme enerjisi ne kadar küçükse bu enerjiye ulaşabilecek tanecik sayısı o kadar fazladır. Dolayısıyla etkin çarpışma sayısı da o kadar fazla olur ve tepkime hızlı gerçekleşir. Aktifleşme enerjisi büyük olan tepkimelerde, taneciklerin çok az bir kısmının kinetik enerjisi aktifleşme enerjisine yetecek değere ulaşır ve tepkime yavaş gerçekleşir.
Eşik enerjiye sahip tanecikler çarpıştığında moleküller birbiri içine girer ve atomlar yeni bir düzenlemeye girebilecek biçimde karmaşık hâle gelir. Bu arada taneciklerin hızı yani kinetik enerjisi azalır, potansiyel enerji de en yüksek seviyesine ulaşır. Bu durumda yüksek enerjili ve kararsız bir ara ürün oluşur. Oluşan bu ürüne aktifleşmiş kompleks denir. Aktifleşmiş kompleks kararsızdır. Enerji vererek potansiyel enerjisini düşürmek ister ve parçalanır.
A2 + B2 ↔ [A2B2]* = 2AB(g)
Girenler Aktifleşmiş kompleks Yüksek enerjili kararsız ara ürün Ürünler
1.5. Potansiyel Enerji Grafikleri
Kimyasal tepkimelerde potansiyel enerji değişimini;
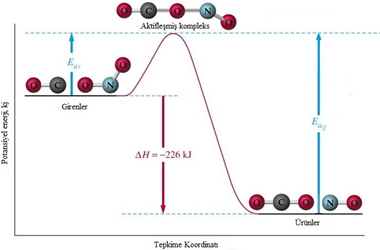
CO (g) + NO2(g) CO2(g) + NO(g) ΔH = -226 kJ/mol
Tepkimesi üzerinde inceleyelim. Bu ekzotermik tepkimenin potansiyel enerjisinin tepkime koordinatına (TK) karşı değişimi görülmektedir.
Tepkime, CO ve NO2 moleküllerinin çarpışmasını gerektirir. Bu moleküller birbirine yaklaştıkça elektron bulutlarının birbirini itmesi sonucunda potansiyel enerji artar. Sonunda iki molekülün çarpışmaları sonucu elektron bulutları birbiri içine girer. Bir geçiş hâli (aktifleşmiş kompleks) oluşur. Başlangıçtaki potansiyel enerji düzeyi ile aktifleşmiş kompleks arasındaki enerji ileri aktifleşme enerjisidir.
İleri AktifleĢme Enerjisi = AktifleĢmiĢ Kompleksin Pot.Enerjisi – Reaktiflerin Pot.Enerjisi
Ekzotermik bir tepkimenin potansiyel enerji – tepkime koordinatı grafiği
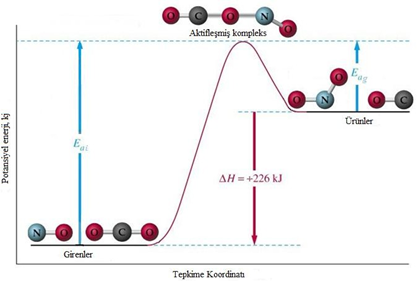
CO ve NO2 molekülleri uygun doğrultuda, yetersiz bir enerji ile çarpışmışlar ise aktifleşmiş kompleks yine oluşur. Ancak aktifleşmiş kompleks molekülleri arasındaki itme kuvvetleri, ürün oluşumunu engeller ve aktifleşmiş kompleks geri yöndeki tepkimenin ürünlerine (CO ve NO2) dönüşür. Geri yöndeki bu tepkime görüldüğü gibi endotermiktir. Tepkimeye girenlerin entalpileri toplamı, ürünlerin entalpileri toplamından küçüktür. Ürünlerle, aktifleşmiş kompleks arasındaki enerji farkı, geri tepkimenin aktifleşme enerjisidir.
Geri Aktifleşme Enerjisi = Aktifleşmiş Kompleksin Pot. Enerjisi – Ürünlerin Pot. Enerjisi
Endotermik bir tepkimenin potansiyel enerji-tepkime koordinatı grafiği
İleri yöndeki ekzotermik tepkimenin, aktifleşme enerjisinin geri yöndeki endotermik tepkimenin aktifleşme enerjisinden küçük olduğu grafik yukarı görünmektedir. Bu durum ileri yöndeki ekzotermik tepkimenin, daima geri tepkimesi olan endotermik tepkimeden hızlı olacağını gösterir. O hâlde aynı Şartlarda gerçekleşen tepkimelerde, aktifleşme enerjisi düşük olanın daha hızlı gerçekleşeceği genellemesi yapılabilir.
Bir tepkimenin ileri aktifleĢme enerjisi (Eai) ile geri aktifleĢme enerjisi (Eag) arasındaki fark, tepkime ısısını verir.
∆H = Eai – Eag
Bir tepkimede; Eai > Eag ise tepkime ekzotermiktir.
Eai < Eag ise tepkime endotermiktir.
Ayrıca tepkime ısısı, girenlerin ve ürünlerin potansiyel enerjileri kullanılarak da hesaplanabilir. Tepkime ısısı, ürünlerin toplam potansiyel enerjisi ile girenlerin toplam potansiyel enerjileri arasındaki farka eşittir.
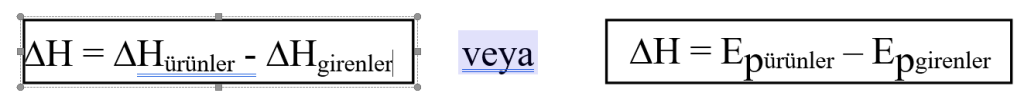
1.6. Tepkime Mekanizması
Tepkimelerin, tepkimeye giren taneciklerin çarpışması ile gerçekleştiği çarpışma teorisinde anlatılmıştı. İki veya üç molekülün çarpışma olasılığı yüksek iken üçten fazla molekülün çarpışma olasılığı oldukça düşüktür.
H2O2 + 2H3O+ + 2I- 4H2O + I2 tepkimesinin deneylerle belirlenen hızının, H2O2 ve I- derişimleriyle doğru orantılı olduğu, H3O+ derişimine ise bağlı olmadığı saptanmıĢtır. Hâlbuki tepkimenin girenler kısmında H2O2, 2H3O+ ve I- tanecikleri vardır. I- iyonunun kat sayısının iki olmasına rağmen hıza H2O2 ile aynı derecede etki etmesi, H3O+ iyonunun ise etki etmemesi, tepkimenin daha basit adımlar üzerinden yürüdüğünü düşündürmektedir. Öyleyse tepkimenin bir adımda değil de birkaç adımda oluştuğunu düşünmek gerekir. Bir tepkimeyi oluşturan bir dizi adımlar sırasına tepkime mekanizması denir.
Gerçekten, beş taneciğin aynı anda çarpışma olasılığı pratikte oldukça zordur. Tepkimenin, aşağıdaki bir dizi adımlardan oluştuğu belirlenmiştir.
Mekanizmadaki I. adım yavaş yürürken, II. ve III. adımların hızlı olması H2O2 ve I- iyonunun tepkime hızına neden aynı derecede etkili olduklarını açıklar. Kısaca, tepkime hızını mekanizmadaki yavaş adım belirler. Mekanizmadaki her adım için bir aktifleşme enerjisi vardır. Yavaş adımın aktifleĢme enerjisi en düşüktür.
1.7. Tepkime Hız İfadesi
X2 ve Y2 moleküllerinin bulunduğu bir kapta X2 ile Y2 arasında, X2(g) + B2(g) →2XY(g) tepkimesi gerçekleşiyor. Kaba bir miktar daha X2 molekülü eklenirse Y2 molekülleri ile çarpışma olasılığı ve dolayısıyla tepkime hızı artar. Yani hız, X2 moleküllerinin derişimi ile orantılıdır.
Tepkime hızı α [X2],
Kaptaki Y2 moleküllerinin sayısı artırılırsa, bu defa X2 molekülleri, çarpışmak üzere daha fazla sayıda Y2 molekülü bulabilecekler ve böylece tepkime hızı Y2nin derişimi ile orantılı olacaktır.
Tepkime hızı α [Y2],
tepkime hızı hem [X2] hem de [Y2] ile orantılı olduğundan, tepkime hızı α [X2] [Y2] yazılabilir. Bir orantı katsayısı (k) kullanılırsa,
tepkime hızı = k [X2] [Y2] olur.
Bu eşitliğe hız denklemi ve eşitlikteki orantı kat sayısı k ye hız sabiti denir. Hız sabiti (k); sıcaklığa, katalizöre ve tepkimenin cinsine bağlıdır. Hız sabitinin birimi tepkimenin derecesine bağlıdır.
aA(g) + bB(g) → cC(g) + dD(g) şeklindeki genel bir tepkimenin hız denklemi şu şekilde ifade edilir. Tepkimenin tek basamaklı olması şartı ile girenlerin kat sayıları hız denkleminde derişimlere üs olarak yazılır. Buna göre;
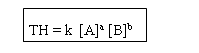
Gaz fazında gerçekleşen tepkimelerde gazların derişimleri kısmi basınçları ile doğru orantılı olduğundan hız bağıntısında derişimler yerine kısmi basınçlarda alınabilir.
TH = k´ (PA)a (PB)b (kısmi basınçlar türünden hız denklemi)
k´ kısmi basınçlar türünden hız sabitidir. k ile k´ değerleri birbirinden farklıdır.
Hız denklemi yazılırken yalnızca tepkime denklemindeki gazlar ve suda çözünmüş maddelerin derişimleri alınır. Saf katıların ve sıvıların deriĢimleri değişmediğinden hız bağıntısına alınmaz.
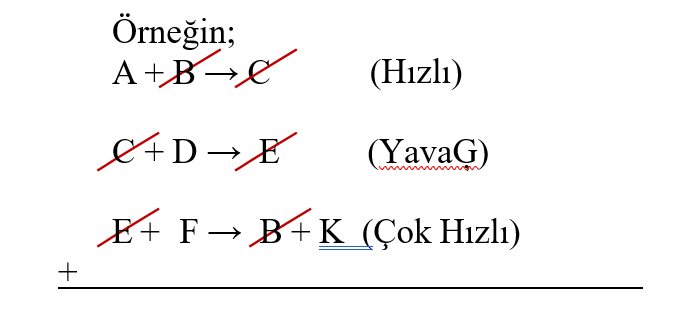
Mekanizmalı tepkimelerde hız denklemi, mekanizmadaki en yavaş adımın girenlerine göre yazılır. Katalizör bu adıma etki eder. Eğer bir adımda giren ve başka adımda çıkan bir madde var ise katalizör, oluşup kaybolan var ise ara üründür.
Top. A + D + F → K
tepkimesinde hız bağıntısı, TH = k[C].[D] dir. B katalizör C ise ara üründür.
Örnek 1: N2(g) + 3H2(g) → 2NH3(g) tepkimesinin hız denklemini yazınız.
Çözüm
Hız denklemi tepkimeye giren maddelerin derişimleri ile orantılıdır. Girenlerin kat sayıları varsa onlar da deriĢimlere üs olarak yazılır. O hâlde,
TH = k [N2] [H2]3 şeklindedir.
Örnek 2: S(k) + O2(g) → SO2(g) tepkimesinin hız bağıntısını yazınız.
Çözüm
Hız denklemi yazılırken yalnızca tepkime denklemindeki gazlar ve suda çözünmüĢ maddelerin deriĢimleri alınır. Saf katıların ve sıvıların deriĢimleri değiĢmediğinden hız bağıntısına alınmaz. O hâlde,
TH = k [O2] Ģeklindedir.
1.8. Tepkime Derecesi
Hız denklemlerinde girenlerin deriĢimlerinin üstleri toplamı, o tepkimenin derecesini verir.
aA(g) + bB(g) → cC(g) + dD(g) şeklindeki genel bir tepkime için, TH = k [A]a [B]b
Tepkime derecesi = a + b’dir.
Örnek 1: Zn(k) + 2HCl(suda) → ZnCl2(suda) + H2(g) tepkimesinin hız denklemini yazarak derecesini bulunuz.
Çözüm
Hız denklemi yazılırken yalnızca tepkime denklemindeki gazlar ve suda çözünmüş maddelerin deriĢimleri alınır. Saf katıların ve sıvıların derişimleri değişmediğinden hız bağıntısına alınmaz. O hâlde hız denklemi,
TH = k [HCl]2 şeklindedir.
Hız denklemlerinde girenlerin derişimlerinin üstleri toplamı, o tepkimenin derecesini verdiğinden derecesi de 2’dir.
Örnek 2: N2(g) + 3H2(g) → 2NH3(g) tepkimesinin derecesini bulunuz.
Çözüm
TH = k [N2] [H2]3
Tepkime derecesi = 1 + 3 = 4’tür.
1.9. Tepkime Hızına Etki Eden Faktörler
Kimyasal bir tepkimenin hızının, girenlerin moleküllerinin yeterli enerji ve uygun doğrultuda çarpışmalarına bağlı olduğu belirtilmişti. Bu tepkimenin hızı, birim zamandaki etkin çarpışma sayısına bağlı olduğuna göre etkin çarpışma sayısını artıran faktörler de hızı artırır.
Yapılan deneyler;
- Madde cinsinin,
- Konsantrasyonun,
- Sıcaklığın,
- Katalizörün,
- Temas yüzeyinin tepkime hızına etki ettiğini göstermiştir.
1.9.1. Tepkime Hızına Madde Cinsinin Etkisi
Tepkime hızı, tepkimeye girenlerin cinsine bağlıdır. Tepkime denklemine bakarak tepkimenin hızlı veya yavaş olduğunu tahmin etmek oldukça zordur. Ancak birtakım basit gözlem ve deneyler yapılarak tepkimenin hızlı veya yavaş olduğu tahmin edilebilir. Hızın sayısal değeri, ancak deneylerle bulunabilir.
Çok sayıda bağın koptuğu ve yeni bağların oluştuğu tepkimeler genellikle yavaş yürür. Kopan bağ sayısı ne kadar çok ise tepkime o kadar yavaş olur. Bir kimyasal tepkimede girenlerin tanecik sayısı ne kadar çoksa (bunların aynı anda çarpışma olasılıkları da o kadar az olacağından) tepkimenin hızı o kadar yavaş olur.
Buna göre;
I. 5Fe+2 (aq) + MnO -(aq) + 8H+(aq) → 5 Fe+3 (aq) + Mn+2(aq) + 4H O(s) (hızlı) MenekĢe (Renksiz)
II.5C2O -2(aq) + MnO -(aq) + 16H+ → Mn+2 (aq) + 10 CO (g) + 8H O(s) (yavaĢ)
I. tepkimede 14; II. tepkimede ise 23 taneciğin çarpışması söz konusudur. Bu iki tepkimede demir iyonu ve okzalat iyonu dışındaki maddeler aynı olduğu hâlde ilk tepkime hızlı, ikincisi ise yavaş yürür. İki tepkime arasındaki hız farkı, Fe+2 iyonun basit bir iyon, okzalat iyonunun ise kovalent bağlar içeren kompleks bir iyon olmasına dayanır. Yani ikinci tepkimede daha çok bağ kırılmakta ve oluşmaktadır.
Zıt yüklü iyonlar arasında gerçekleşen tepkimeler, elektrostatik çekim kuvvetinin olmasından dolayı genellikle çok hızlıdır.
Örneğin;
Ag+(aq) + Cl-(aq) → AgCl(k) tepkimesi çok hızlı olur.
1.9.2. Tepkime Hızına Konsantrasyonun Etkisi
Bir tepkimede girenlerin derişimini artırmak tepkimeyi hızlandırır. Çünkü girenlerin derişiminin artması demek çarpışma sayısının artması demektir. Bu durumda tepkimelerin hızı, tepkimeye giren maddelerin derişimleri ile orantılıdır. Teorik olarak bulunan hız denklemi ile deney sonucu bulunan hız denklemi her zaman aynı olmaz. Hızın sayısal değeri ancak deneyle bulunabilir.
Örnek: 2H2(g) + 2NO(g) → N2(g) +2H2O(g) tepkimesinde NO derişimi iki katına çıkarıldığında hızın dört katına çıktığı gözleniyor. H2 ve NO derişimleri birlikte ikişer katına çıkarılınca hızın 8 katına çıktığı saptanıyor. Tepkimenin hız bağıntısını ve derecesini belirtiniz.
Çözüm: Sayılar arasındaki matematiksel ilişkilerden şu düşünce kolayca üretebilir: Her ikisi de 2 katına çıkınca hız 8 katına çıktığına göre tepkime 3. dereceden olmalıdır. Çünkü ancak 2’nin üçüncü kuvvetiyle 8 sayısına varılır. Öte yandan NO’nun derişimi 2 katına çıkınca hız 4 katına çıktığına göre bu madde hız bağıntısında kare olarak yani ikinci dereceden yer alır. Öyleyse,
Tepkime hızı = k [H2] [NO]2
Şeklinde yazılabilir.
Tepkime, H2ye göre birinci, NO’ya göre ikinci, toplam olarak üçüncü derecedendir.
1.9.3. Tepkime Hızına Sıcaklığın Etkisi
Sıcaklığın artırılması, taneciklerin kinetik enerjilerinin artmasına neden olur. Tepkimeye giren taneciklerin kinetik enerjisinin artması, hızlarının artmasına daha sık ve etkin çarpışmalar yapmalarına neden olur. Böylece aktifeşmiş kompleks oluşturan tanecik sayısı ve tepkime hızı artar.
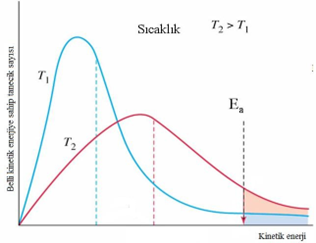
Sıcaklık artışı, Ea eşik enerjisini aşan tanecik kesrini çoğaltır. Sıcaklığın tepkime hızına etkisini verilen Maxwell-Boltzmann enerji dağılım eğrileri ışığında da incelenebilir. Bu eğrilerde Ea’ya eşit veya daha büyük enerjiye karşı gelen bölgenin altında kalan alan, kinetik enerjisi Ea’ya eşit veya Ea’dan daha yüksek enerjili molekül yüzdesine karşılıktır. Sıcaklık arttıkça bu alan da artmaktadır. Ea dağılım eğrisinin bitimine yakın bir yerde sıcaklığın değişmesi bu alanı büyük ölçüde değiştirir. Yani birbiriyle çarpışan moleküllerden yalnız enerjileri belli bir “eşik enerjisi”nin üstünde olanlar tepkime verebilir. Bu nedenle tepkime hızları sıcaklığa karşı toplam çarpışma sayısından daha duyarlıdır.
Sonuç olarak sıcaklık artışı;
• Ea eşik enerjisini aşan tanecik sayısını artırır.
• Hem çarpışma sayısını hem de etkin doğrultuda çarpışma sayısını artırır.
Bu iki etken, hız sabitinde artış olarak kendini gösterir.
T1 ve T2 sıcaklıklarındaki taneciklerin kinetik enerji dağılımı
Hız sabiti (k) sıcaklık arttıkça artar. k ile T arasındaki ilişki üsteldir. Bu nedenle T’deki küçük bir değişme, k’de oldukça büyük bir değişmeye neden olur. Hız sabitindeki bu değişme, tepkime hızına da yansır.
1.9.4. Tepkime Hızına Katalizörün Etkisi
Bir kimyasal olayın başlaması ve yürümesi için zorunlu olmadığı hâlde, tepkime ortamına girince hızı değiştiren maddelere katalizör denir. Katalizörler, tepkime sonunda kimyasal olarak değişmeden kalan ve yeniden kullanılabilen maddelerdir. Tepkime hızını artıranlara pozitif; azaltanlara da negatif katalizör (inhibitör) adı verilir. Katalizörün etkisine ise, kataliz denir.
Vücudumuzda ve yaşamımızda önemli bir yer tutan enzimler, biyolojik katalizörlerdir. Tükürükte bulunan pityalin, mide öz suyunda bulunan pepsin, protein ve nişasta gibi büyük moleküllü maddelerin daha küçük parçalara ayrılmasını hızlandırır. Mayalanma olayında da enzimler işbaşındadır.
Katalizörler, tepkimede değişikliğe uğramadıklarından net tepkime denklemlerinde gösterilmez. Tepkime okunun üzerine yazılır.
Yukarıdaki tepkimede MnO2 katalizördür. Katalizörler, başlaması mümkün olmayan tepkimeleri başlatamaz ve her tepkimenin katalizörü farklıdır.
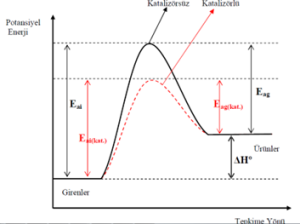
Katalizörler, aktifleşme enerjisini küçültür, girenlerle daha düşük enerjili yeni bir aktifleşmiş kompleks oluşturur. Böylece aktifleşme enerjisini aşabilen tanecik sayısı ve tepkime hızı artar.
Katalizör hem ileri hem de geri yöndeki aktivasyon enerjisini aynı oranda düĢürür. Bu yüzden katalizör kullanmak bir tepkimenin ΔHº değerini değiştirmez.
Bir tepkimenin katalizörlü ve katalizörsüz potansiyel enerji grafiği
Katalizörlerin Genel Özellikleri
- Gerçekleşmesi mümkün olmayan tepkimeleri başlatamaz.
- Her tepkimenin kendine özgü katalizörü vardır.
- Tepkime mekanizmasını ve hız sabitini değiştirir.
- Tepkimelerin aktifleşme enerjisini düşürerek enerji engelini aşan tanecik sayısını artırıp tepkimeyi hızlandır.
- Tepkimelerin ileri ve geri aktifleşme enerjisini eşit ölçüde azaltarak tepkime ısısının işaretini ve sayısal değerini değiştirmez.
- Aktifleşmiş kompleksin enerjisini düşürür.
- Tepkimelerin yönünü, ürün miktarını ve türünü değiştirmez.
- Katalizörler net denklemlerde yer almaz. Tepkime okunun üzerine yazılır.
- Katalizör sadece mekanizmadaki en yavaş adımın aktifleşme enerjisini düşürür. Diğer adımları etkilemez.
Tepkime Hızına Temas Yüzeyinin Etkisi
Tepkimeye giren maddeler, aynı fiziksel durumda değilse (tepkime heterojen fazlar arasında oluyorsa) temas yüzeyinin büyüklüğü tepkime hızını etkiler. Söz gelimi odunun ya da kömürün yanmasının hızı, yüzey büyüdükçe artar. Bu da örneğin oduna göre talaşın, parça kömüre göre toz kömürün neden daha hızlı yandığını açıklar. Benzer biçimde roketlerde kullanılan katı ateşleme maddelerinin yüzeyleri büyüdükçe itme gücü de büyür. Patlamanın hızı, patlama ilerledikçe ateşleme maddesinin yüzeyinin ne kadarlık bir bölümünün havayla ilişkide olduğuna bağlıdır.
İki beherden birine çinko parçası, diğerine de aynı kütlede toz hâline getirilmiş çinko konulur ve üzerine bir asit çözeltisinden eşit miktarda eklenirse çinko tozunun bulunduğu beherde hidrojen gazı çıkışının çok daha hızlı olduğu görülür. Toz çinkoda çarpışma yüzeyi daha büyüktür. Her iki beherde şu tepkime olur:
Zn(k) + 2H+(aq) → Zn+2 + H2(g)
Örnek:
I. Zn(k) + H2SO4(aq) → ZnSO4(aq) + H2(g)
II. 2H2(g) + 2NO(g) → N2(g) + 2H2O(g)
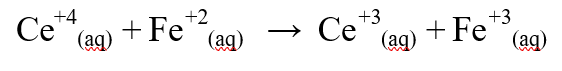
Ce+4(aq)+Fe+2=Ce+3(ag)+Fe+3(ag)
Yukarıdaki tepkimelerden hangisi ya da hangilerinde giren maddelerin yüzeyinin artırılması hızı artırır?
Çözüm:
Tepkime heterojen fazlar arasında oluyorsa temas yüzeyinin büyüklüğü tepkime hızını etkiler. Bu nedenle I. tepkimede giren maddelerin yüzeyinin artırılması hızı artırır. II. ve III. homojen tepkimeler olduğundan temas yüzeyinin artırılması hızı etkilemez.